Cell: TRPC5缺失导致肥胖和产后抑郁
研究背景
人类的先天行为,如觅食、抚育后代、自我保护及社交,皆由基因所编码,对生存与繁衍至关重要。这些行为的启动与维持依赖于下丘脑神经元的精密调控。下丘脑神经元回路能够敏锐地感知体内外环境的变化,并从中选择最适宜的行为反应,赋予先天行为一定的可变性和可塑性。2024年7月,贝勒医学院徐勇教授团队联合剑桥大学I. Sadaf Farooq教授团队在Cell期刊上发表了题为Loss of transient receptor potential channel 5 causes obesity and postpartum depression的文章,揭示了下丘脑中的TRPC5在调控人类生存必需的先天行为中发挥着关键作用。
瞬时受体电位(TRP)蛋白是一类非选择性阳离子通道,可将感官刺激转化为大脑可解读的电信号。瞬时受体电位通道5(TRPC5)是TRP通道蛋白家族成员之一。前期研究证明,TRPC5在下丘脑阿黑皮素原(POMC)神经元中表达,并能被瘦素、胰岛素和血清素激活,参与机体能量平衡的调控[1,2]。研究还发现,在大脑和POMC神经元中特异性敲除Trpc5会导致小鼠摄食增加、能量消耗减少,进而引发肥胖[3]。
研究内容
1. 人类TRPC5缺失引起肥胖、焦虑和适应不良
首先,研究者在两个患有严重肥胖症的男孩身上发现了Xq23染色体上TRPC5基因的微缺失,这两个男孩分别来自两个无血缘关系的家庭,并且已排除了所有已知的肥胖遗传因素(图1A)。这两位先证者的母亲和兄弟同样患有肥胖症,且均携带TRPC5基因的缺失(图1B),而两家的父亲则未表现出肥胖症。这一发现提示TRPC5基因的缺失可能与一种X连锁显性肥胖综合征相关联。此外,两位先证者还患有严重的自闭症与焦虑症,而他们的母亲除焦虑症外,还罹患严重的产后抑郁症。
接着,研究者通过对984名严重肥胖症患者进行外显子测序,发现编码TRPC5基因的片段存在7个罕见的突变(图1C)。作者通过在HEK293细胞中转染带有突变的TRPC5,发现K34del和S884突变造成的TRPC5功能缺失最为严重(图1D)。通过放线菌酮追踪实验,研究者发现带有K34del和S884突变的蛋白降解速度明显加快(图1E)。带有K34del突变的细胞膜表达水平降低,而携带其他突变体的细胞膜表达水平正常(图1F)。在电生理实验中,作者发现表达野生型TRPC5的HEK293细胞能够产生强烈的内向电流,而表达携带TRPC5突变体的细胞内向电流显著减弱。以上实验证明,这些罕见突变体能够引起TRPC5的功能缺失(图1G)。
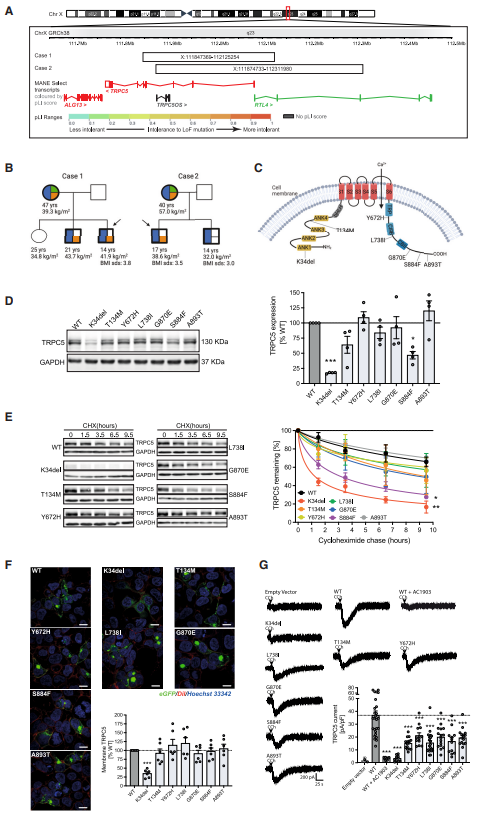
图1 人类TRPC5缺失突变导致肥胖、焦虑和产后抑郁
2. TRPC5突变敲入雄性小鼠出现肥胖、焦虑和社交能力下降
为了确定TRPC5功能缺失是否会导致肥胖等表型,研究者构建了一个人类功能缺失TRPC5基因突变的敲入(Trpc5K34del/Y)小鼠模型。研究发现,相比于野生型(WT)小鼠,Trpc5K34del/Y雄性小鼠在高脂喂养下,摄食量、体重和体脂均显著增加(图2A-C)。此外,Trpc5K34del/Y小鼠的活动量没有变化,但能量消耗显著降低(图2D-E)。研究者还发现,Trpc5K34del/Y小鼠在28度的环境温度下表现出更强的囤积食物行为(图2F-G)。
在矿场实验中,Trpc5K34del/Y小鼠表现出明显的焦虑样行为,其运动距离、进入中心的次数和时间以及站立时间显著减少(图2H)。除此之外,Trpc5K34del/Y小鼠在禁食状态下的清醒时间增加(图2I)。在三箱社交实验中,相比WT小鼠,Trpc5K34del/Y小鼠的与另一只小鼠的互动减少,社交能力降低(图2J-K)。在居住者入侵实验中,Trpc5K34del/Y小鼠攻击潜伏期缩短,攻击次数和持续时间增加(图2L-N)。
以上实验说明,在雄性小鼠中,Trpc5的人类功能缺失突变会导致肥胖、焦虑、社交能力降低和攻击行为增加。

图2 Trpc5缺失突变敲入雄性小鼠出现代谢和行为缺陷
3. Trpc5 缺失导致雌性小鼠产后抑郁和母性行为异常
相比WT小鼠,雌性Trpc5 缺失突变敲入(Trpc5K34del/+)小鼠在高脂喂养下摄食量、体重和体脂量均显著增加(图3A-C),并且在28度的环境温度下展现出更强的食物囤积行为(图3D-E)。当环境温度从24度升高至28度时,两组小鼠的能量消耗均有所减少,且Trpc5K34del/+小鼠活动量显著低于WT小鼠(图3F-G)。此外,WT小鼠的呼吸交换率在温度升高时显著增加,而Trpc5K34del/+小鼠的呼吸交换率在温度变化下没有明显变化,且始终低于WT小鼠(图3H)。以上实验说明,Trpc5缺失突变削弱了小鼠对环境温度变化的适应能力。
研究者接着探究了雌性小鼠在产后的行为学的变化。结果显示,Trpc5K34del/+小鼠表现出明显的产后行为异常:它们丢弃仔鼠的行为增加,母性行为(包括蹲伏、理毛、筑巢和衔回幼崽等)显著减少(图3J-O)。研究者接着在矿场中检测了母鼠衔回幼崽的行为,结果显示Trpc5K34del/+小鼠衔回幼崽的潜伏期增加,衔回幼崽的总数和舔舐幼崽的次数均减少(图3P-Q)。研究还发现,Trpc5K34del/+小鼠哺乳期间的催乳素分泌严重受损(图3R)。在断奶后,Trpc5K34del/+小鼠强迫游泳不动时间增加,糖水偏好率下降(图3S-T)。以上实验说明,Trpc5缺失突变在引起小鼠母性行为受损的同时,还会引发产后抑郁。
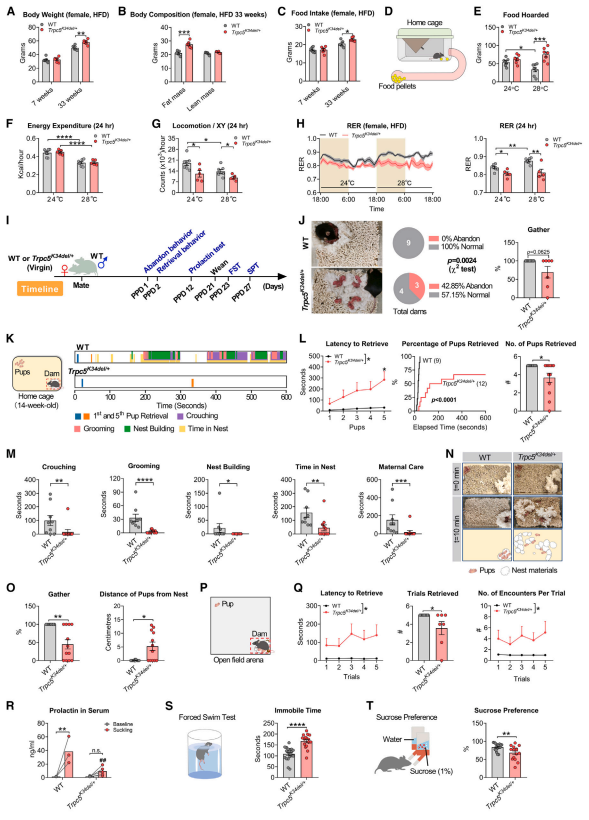
图3 Trpc5缺失突变敲入雌性小鼠出现代谢和行为缺陷
4. Trpc5通过调控下丘脑 POMC 影响摄食
在下丘脑弓状核内,研究者发现91%的阿黑皮素原(POMC)神经元共表达Trpc5(图4A)。前期研究表明,在POMC神经元中特异性敲除Trpc5会导致过度摄食和肥胖。在本研究中,研究者进一步发现,给予BTD(一种Trpc5激动剂)能够抑制WT小鼠摄食,并增强POMC神经元的活性(图4B-D);然而,当对POMC神经元进行化学失活后,BTD所引发的摄食抑制作用明显减弱(图4E-F)。研究还证实,Trpc5功能缺失突变减弱了BTD的摄食抑制作用和POMC激活效应(图4G-H)。同时,研究者发现,BTD能够使WT雌鼠在高脂喂养的情况下摄食量减少,体重降低;然而,BTD并不能够使Trpc5K34del/+雌鼠的摄食量和体重发生明显改变(图4I-K)。这些研究结果表明,Trpc5的功能缺失突变削弱了POMC神经元介导的摄食抑制作用。
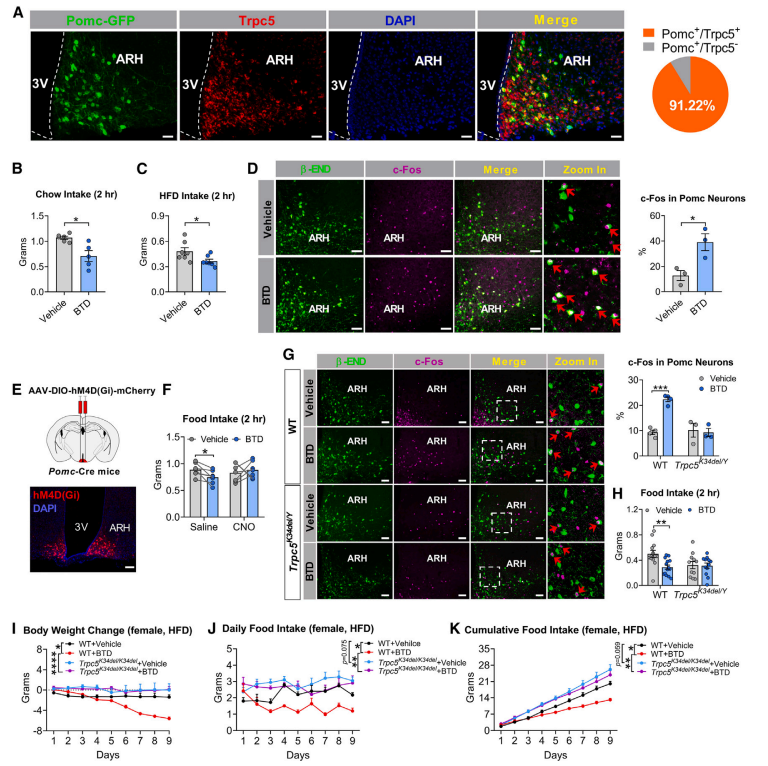
图4 Trpc5缺失会削弱Pomc神经元介导的摄食抑制
5. 敲除OXT神经元Trpc5基因可导致肥胖
研究者发现,下丘脑室旁核(PVH)中存在大量的Trpc5表达,并且与34%的缩宫素(OXT)神经元共定位(图5A)。进一步的研究表明,在OXT神经元中敲除Trpc5后,小鼠的摄食量、体重、体脂和肌肉量均明显增加 (图5B-D)。代谢笼实验显示,OXT神经元Trpc5敲除(Trpc5f/Y/OXT-Cre)小鼠的摄食量增加,活动量减少,但能量消耗(将体重作为协变量)保持不变(图5E-G);这表明Trpc5缺失导致的食欲亢进是小鼠肥胖的主要驱动因素。这些结果表明,除POMC神经元外,Trpc5还可通过OXT神经元来调节摄食和体重。
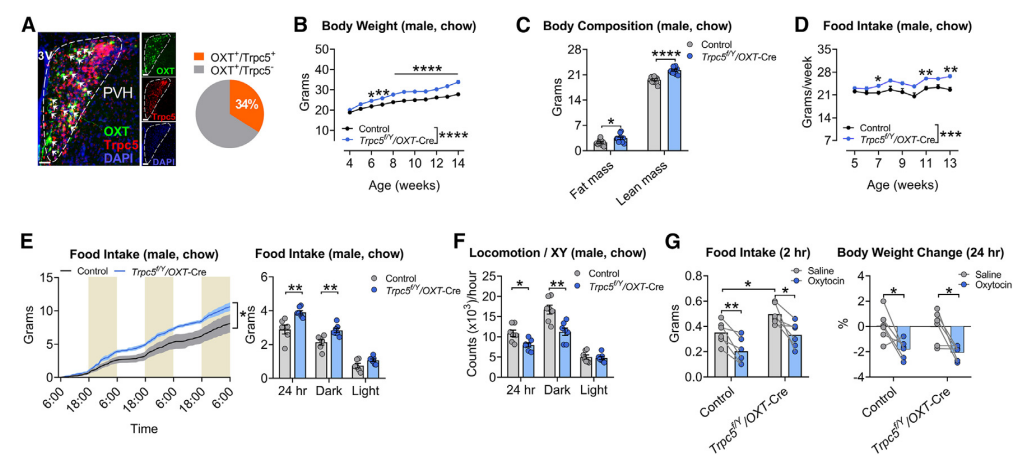
图5 敲除OXT神经元 Trpc5 基因可导致肥胖
6. Trpc5 通过调控OXT神经元影响情绪
研究者接着对Trpc5f/Y/OXT-Cre小鼠进行了行为学测试。在矿场实验中,Trpc5f/Y/OXT-Cre小鼠表现出明显的焦虑样行为,其运动距离、进入中心的次数和时间以及在旷场中的站立时间均减少(图6A-B)。在三箱社交实验中,Trpc5f/Y/OXT-Cre小鼠互动时间减少,社交能力显著下降(图6C)。
哺乳期间,在OXT神经元敲除Trpc5(Trpc5f/+/OXT-Cre)的雌鼠衔回幼崽和母性照料行为显著受损(图6D-H)。断奶后,雌鼠强迫游泳时的不动时间增加,糖水偏好率下降,表现出明显的抑郁样行为和快感缺失(图6I-J)。
以上实验结果说明,从OXT神经元中敲除Trpc5可导致小鼠焦虑、社交能力下降、母性行为受损和产后抑郁。
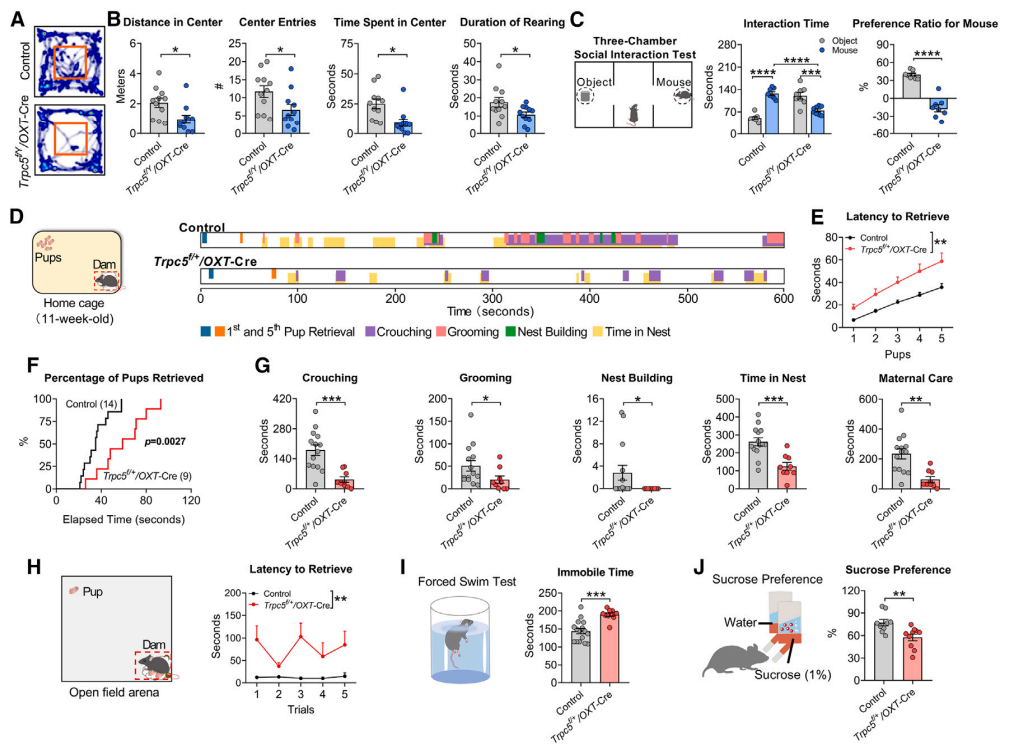
图6 敲除OXT神经元 Trpc5 基因可导致产后抑郁
7. 在下丘脑恢复Trpc5 可挽救突变小鼠的代谢和行为缺陷
为了研究 Trpc5 在下丘脑OXT 神经元中的作用,研究者构建了一种携带 WT Trpc5 的腺病毒载体(AAV-DIO-Trpc5),使Trpc5K34del/OXT-Cre 小鼠的OXT 神经元选择性地过表达功能性Trpc5 (图7A)。研究者发现,雄性小鼠在恢复Trpc5表达后体重增长减缓,摄食减少(图7B-E);焦虑样行为和社交行为得到改善(图7F-I)。而雌性小鼠在恢复表达Trpc5后,哺乳期衔回幼崽和照料幼崽的行为显著改善(图7J-O);产后抑郁样行为亦得到改善(图7P-Q)。
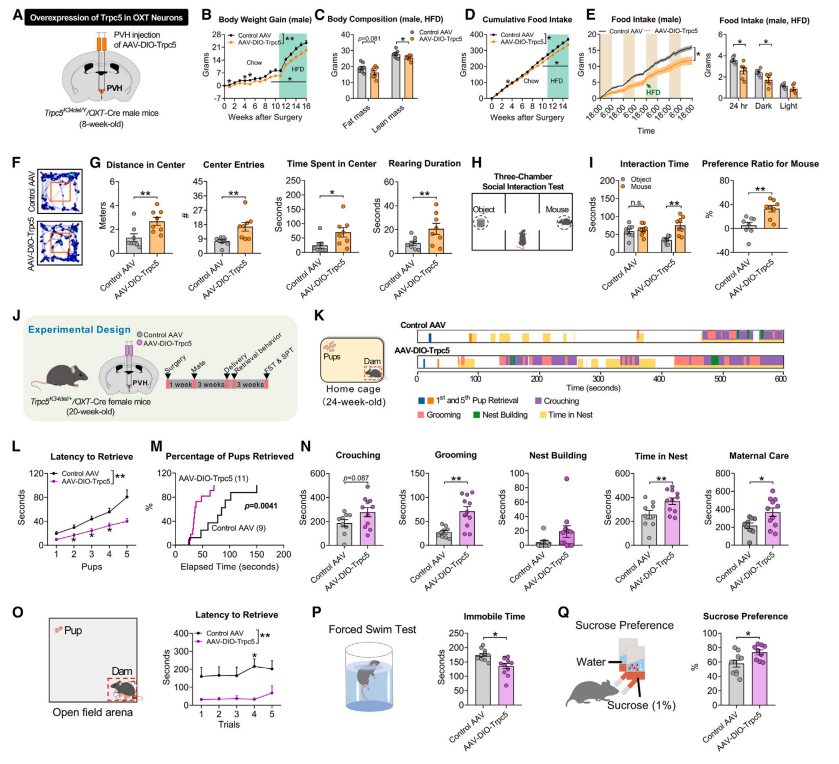
图7 在OXT神经元恢复表达Trpc5可逆转突变小鼠的代谢和行为表型
总结与展望
该研究工作主要证实了人类TRPC5缺失会导致肥胖、焦虑、自闭和产后抑郁,并且这些表型可以在携带人类 TRPC5 功能缺失突变的小鼠中再现。此外,研究还发现TRPC5主要通过作用于下丘脑的POMC和缩宫素神经元来调节包括进食、焦虑、社交和母性关怀等在内的先天行为。这些结果表明,下丘脑中的TRPC5可能是治疗肥胖症和产后抑郁症的一个重要靶点。然而,TRPC5调节进食和情绪等先天行为的具体分子机制仍需进一步研究。
原文链接:https://doi.org/10.1016/j.cell.2024.06.001
小编:吴佳颖
参考文献:
[1] Qiu J, Fang Y, Rønnekleiv O K, 等. Leptin excites proopiomelanocortin neurons via activation of TRPC channels[J]. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 2010, 30(4): 1560-1565.
[2] Sohn J W, Xu Y, Jones J E, 等. Serotonin 2C receptor activates a distinct population of arcuate pro-opiomelanocortin neurons via TRPC channels[J]. Neuron, 2011, 71(3): 488-497.
[3] Gao Y, Yao T, Deng Z, 等. TrpC5 mediates acute leptin and serotonin effects via pomc neurons[J]. Cell Reports, 2017, 18(3): 583-592.



