Nature Cell Biology:低输入脂质组学揭示哺乳动物早期胚胎发育过程中的脂质代谢重塑
研究背景
2024年2月1日,浙江大学基础医学院/浙江大学医学院附属第一医院/良渚实验室张进团队、中国科学院遗传与发育生物学研究所税光厚团队、中国医科大学附属盛京医院生殖医学中心李达团队在 《Nature Cell Biology》 期刊上发表了题为 "Low—input lipidomics reveals lipid metabolism remodelling during early mammalian embryo development "的研究论文,该项工作系统描绘了小鼠和人早期胚胎发育过程中动态变化的脂质图谱,并阐明了脂质不饱和度调控胚胎发育的功能与机制。
脂质广泛存在于人体细胞中,具有能量储存、构成膜结构、信号转导和能量供给等功能。近年来,脂质代谢在卵母细胞和植入前胚胎代谢中的重要性逐渐被发现。在植入前小鼠胚胎中,左旋肉碱被证明可以增加细胞内脂质代谢并改善胚胎发育。提示脂质代谢在植入前胚胎发育中可能扮演重要的角色。
哺乳动物完成受精后,具有全能性的受精卵经历三到四轮细胞分裂,随后在8细胞阶段被压实然后逐步发育成桑葚胚及囊胚。囊胚包含内细胞团(ICM)和滋养外胚层(TE)细胞。在早期胚胎发育过程中,染色质可及性改变并发生表观遗传重编程。这些动态转变与代谢重编程有关,如卵裂期早期的胚胎处于静止状态,在葡萄糖成为必需营养素之前,由丙酮酸和乳酸为小鼠受精卵从单细胞至桑椹胚的发育提供支持。此外,代谢物还在发育和细胞命运决定中起着关键作用,如葡萄糖可以区分TE和ICM细胞的细胞命运。然而,在众多代谢物研究中,脂质代谢很少受到关注,尤其关于小鼠和人类胚胎发育的动态脂质景观是缺失的。
研究内容
1、小鼠着床前胚胎发育阶段特异性脂质组学特征
首先,研究人员通过高分辨率质谱靶向脂质组学分析平台,实现了在少量胚胎(120个植入前胚胎)水平上进行代谢物的检测,可以鉴定到23大类脂质共300余种脂质分子,包括甘油磷脂、鞘脂和中性脂。进一步地,研究人员建立动物模型(图1a)并测定了自MII期卵母细胞到囊胚期各阶段的脂质组成。尽管组间存在差异,但每个阶段的样本主成分分析结果大致聚集,并与其他阶段重叠较小,表明不同的胚胎发育阶段具备不同的脂质组学特征。其中囊胚期与其他所有阶段的分离最为明显,提示胚胎发育至此阶段后脂质组成发生了重大变化(图1b)。对该样本进行进一步脂质组学分析,共检测到23类332种脂类,包括甘油磷脂、甘油、鞘磷脂和胆固醇等(图1c)。
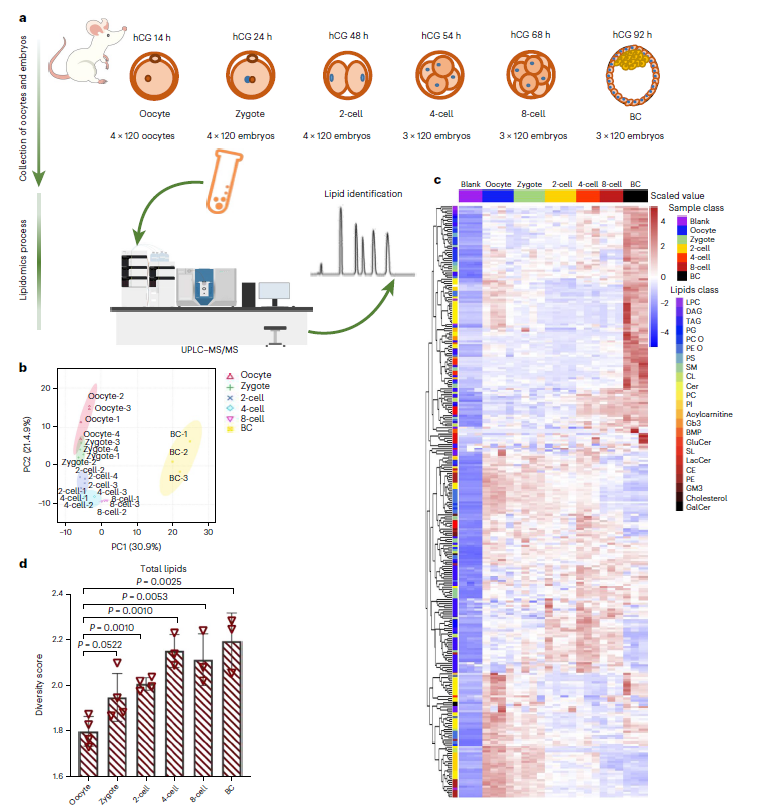
图1:小鼠着床前胚胎发育阶段特异性脂质组学特征
为了更明确的分析胚胎发育过程中脂质代谢的变化,作者使用maSigPro(一种在时序微阵列实验中识别显著差异表达谱的方法)找到了五个不同的脂质簇,用于观察不同时期的脂质调节趋势。其中,第1簇由发育过程中减少的脂质组成,主要包括PEs(磷脂酰乙醇胺)和PIs(磷脂酰肌醇),这些脂质的富集可能对卵母细胞的激活和受精有重要作用。簇2代表在卵母细胞中丰富的脂质,在受精后耗尽,并在囊胚阶段逐渐补充。长链脂肪酸磷脂酰胆碱(PCs)在这个簇中占主导地位,考虑到它们是质膜的主要成分,其富集现象表明囊胚时期可能存在动态的膜重构行为。簇3代表在囊胚阶段特殊需要的脂质。除了特定的磷脂酰胆碱外,该簇还包括鞘磷脂(SMs),其增加可能对膜上的微结构域形成至关重要,以支持囊胚期信号分子的分布。4和5簇包括从2细胞期和4细胞期逐渐出现的脂质,即受精卵基因组激活后立即发生生物合成的新生脂质类型(图2d、e)。对以上数据使用多样性指数进行处理,发现在发育过程中脂质种类变得更加多样化并趋于均匀分布,这可能是为了适应日益复杂的生物过程(图1d)。
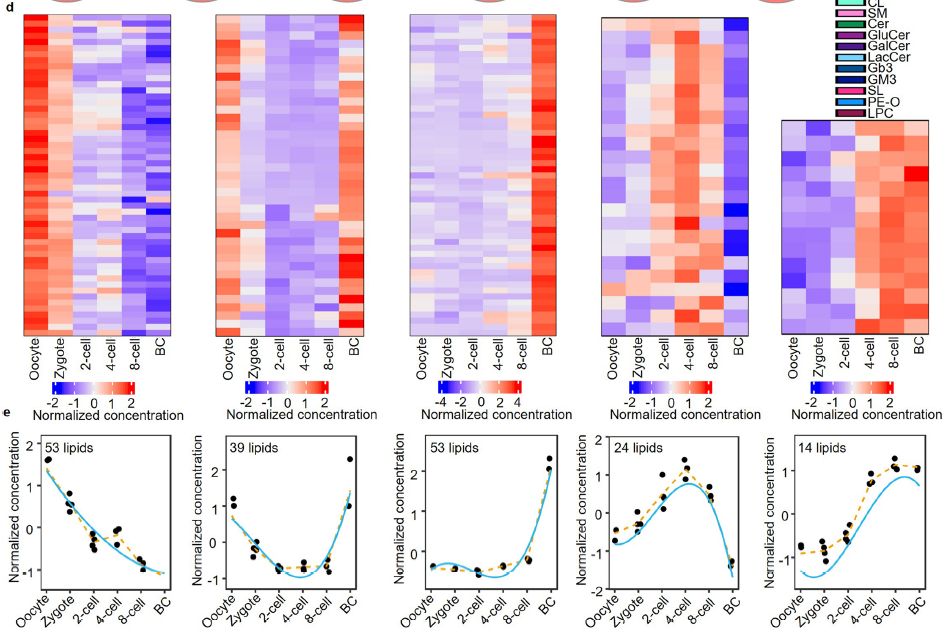
图2:小鼠着床前胚胎发育过程中脂质组学的动态变化
2、小鼠着床前胚胎发育过程中个体脂类的动态变化反应其介导的相关功能
为进一步了解各类脂质在着床前发育过程中的动态变化及其功能,研究人员将脂质分为甘油磷脂、鞘氨醇脂质和中性脂质三类,并分别分析了各脂类的丰度。首先,甘油磷脂作为细胞膜的主要成分,主要包括磷脂酰胆碱(PCs)、磷脂酰乙醇胺(PEs)、磷脂酰肌醇(PIs)、磷脂酰丝氨酸和心磷脂。其中最主要的成分是磷脂酰胆碱(PCs),其丰度呈双峰分布,在卵母细胞和囊胚阶段含量较高,较长的不饱和脂肪酸酰基链在囊胚期富集(图3a)。而磷脂酰乙醇胺(PEs)在卵母细胞中表现出稳定的丰度下降,与PC不同,PE在囊胚阶段并没有得到补充(图3b)。PCs和PEs主要存在于质膜,表明在发育过程中膜组分存在动态重构。此外, PC Os (即含有多不饱和脂肪酸的磷脂酰胆碱)在囊胚期显著增加(图3c),而除了高不饱和PE O以外大多数PE Os 丰度下降(图3d),提示这些上调表达的磷脂可能作为一种潜在的抗氧化剂维护影响细胞膜流动的胆固醇稳态。PIs(磷脂酰肌醇)在卵母细胞和受精卵中水平最高,并在发育过程中逐渐降低(图3e)。在卵母细胞发育过程中,PIs作为信号分子发挥作用,其磷酸化的水解产物IP3可以识别并结合内质网膜表面受体,使Ca2+释放到胞质溶胶中,并在受精时促进卵母细胞活化。
第二类是鞘氨醇脂质,主要由神经酰胺、鞘磷脂(SMs)和鞘糖脂组成,在细胞膜上与胆固醇一起形成专门的微结构域,称为脂筏,能够促进细胞信号转导、分裂和分化。分析表明,大多数鞘磷脂分子在向囊胚发育的过程中变得更加富集(图3f),且脂筏微结构域的比率在这个过程中增加(图3g),这个结果进一步在胚胎的活体脂筏染色中也得到验证(图3h)。在发育过程中,脂筏的形成增加,可能是为适应囊胚时期增强的信号转导。
第三类是以甘油三酯为主的中性脂,甘油三酯的含量在4细胞期开始至囊胚期有明显的增加,是脂滴的主要成分。其主要功能之一是储存能量,提示甘油三酯可以为胚胎发育后期代谢活动的增强氧化供能。
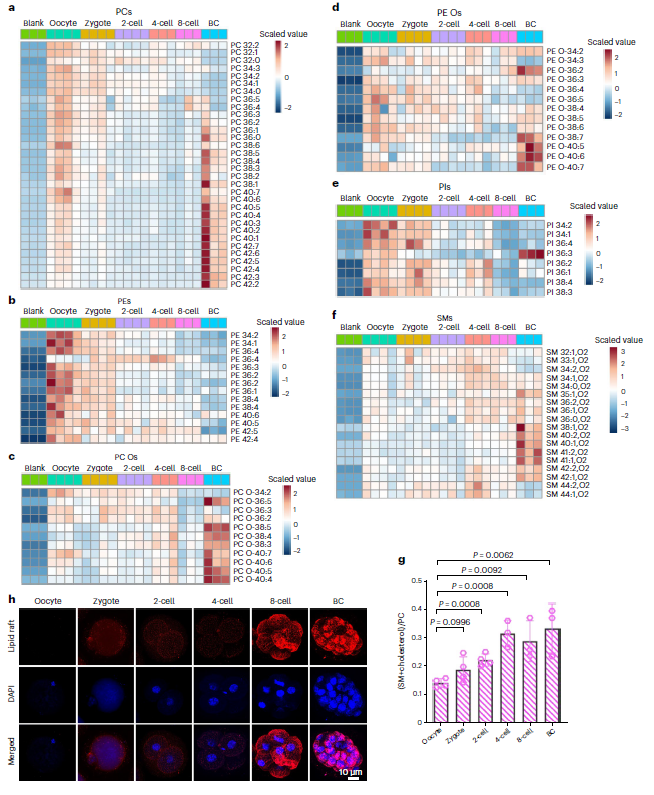
图3:小鼠着床前胚胎发育过程中单种脂类含量的动态变化及其相关功能分析
3、人类及小鼠植入前胚胎发育过程中脂质不饱和增加
在完成脂质组学图谱的构建后,作者对已经得到的脂质组学数据进行深入分析,发现在植入前胚胎发育过程中,碳双键的数量随着碳氢链长度的增加而增加(图4a),不饱和脂质的含量也在成熟过程中上升,以磷脂PCs、PEs、心磷脂(CL)和 双(单酰基甘油)磷酸酯(BMP)上升更加明显,与其他类别相比具有更突出的不饱和特性(图4b)。此外,与2细胞期胚胎相比,多不饱和的脂质在囊胚中的种类与含量都升高(图4c)。
由于磷脂组成和不饱和程度对膜流动性有实质影响,可以推测不饱和脂肪酸的上调能够更好地促进细胞膜的流动如细胞分裂与极化。为进一步验证该结论,研究人员测定不同发育阶段单/双不饱和脂质与饱和脂质的比例、多不饱和脂质与饱和脂质的比例(图4d),结果显示出明显的双峰趋势,即在2细胞期胚胎阶段较低,在卵母细胞和囊胚阶段较高。这一现象也在单个脂质类别如PC的数据中得到验证(图4e)。归一化不同类别的脂类浓度后,2细胞期胚胎的不饱和脂质含量仍与囊胚期存在显著区别(图4f),可以大致认为,脂质不饱和的升高是胚胎发育到囊胚期的保守特征。通过针对脂质代谢相关基因的转录组学分析证明,囊胚期的ICM和TE细胞中不饱和脂肪酸的生物合成通路发生上调以满足胚胎发育的需要(图4g)。
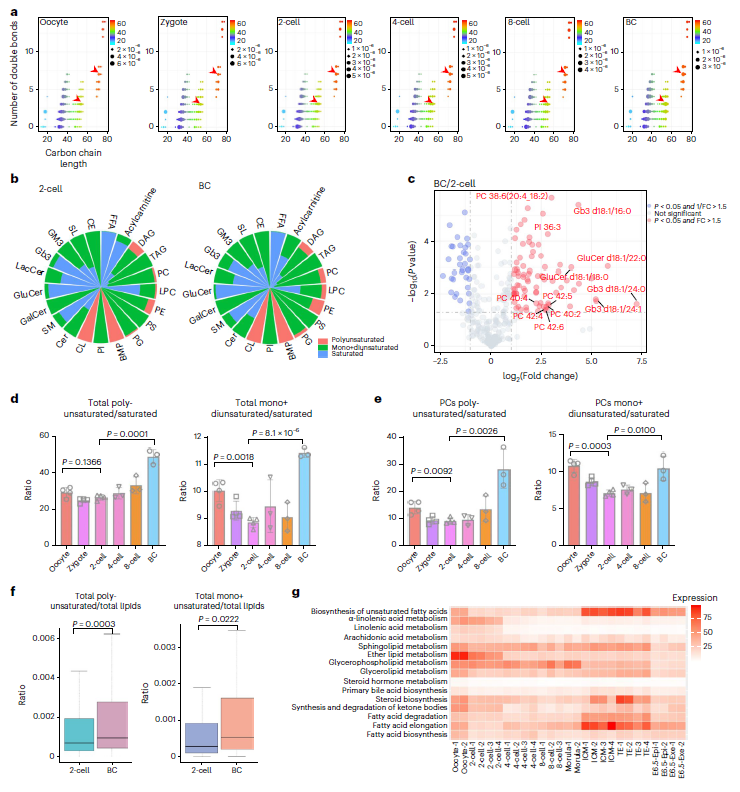
图4:小鼠着床前胚胎发育过程中脂质不饱和程度增加
为了探究该结论对人类胚胎的适用性,研究人员绘制了体外受精后冷冻的人类8细胞胚胎样本的脂质组学图谱(图5a),人类8细胞胚胎在全能性状态方面与小鼠2细胞胚胎相对应。结果发现植入前胚胎包含的脂质种类、发育过程中脂质组学变化趋势、以及囊胚期脂质不饱和度增高方面均存在物种之间的保守性(图5b)。
研究者同时提出新的科学问题:囊胚阶段富集的不饱和脂质从何而来?通过转录组学分析结果发现,ICM阶段上调的脂代谢基因富集了用于合成不饱和脂肪酸的基因,一些关键的脂质分子去不饱和酶的表达水平也在这一过程中显著上调,包括Δ5、Δ6和Δ9 酶。其中Δ9酶负责在饱和脂肪酸如棕榈酸和硬脂酸中形成不饱和键,催化合成单不饱和脂肪酸(MUFA)棕榈油酸和油酸。而Δ5和Δ6酶进一步合成多不饱和脂肪酸(PUFA)。在对碳链长度为十六和十八碳的饱和脂肪酸与不饱和脂肪酸总含量进行检测后,研究人员观察到与2细胞期胚胎相比,囊胚中C18单不饱和脂肪酸的含量和C18单不饱和与饱和脂肪酸的含量比增加,且以单个类别的PI最为明显。这些结果提示Δ9酶在早期胚胎发育中起作用,油酸可能是小鼠早期胚胎中更主要的单不饱和脂肪酸(图5c-h)。重要的是,在人类胚胎中也观察到相同现象(图5i)。
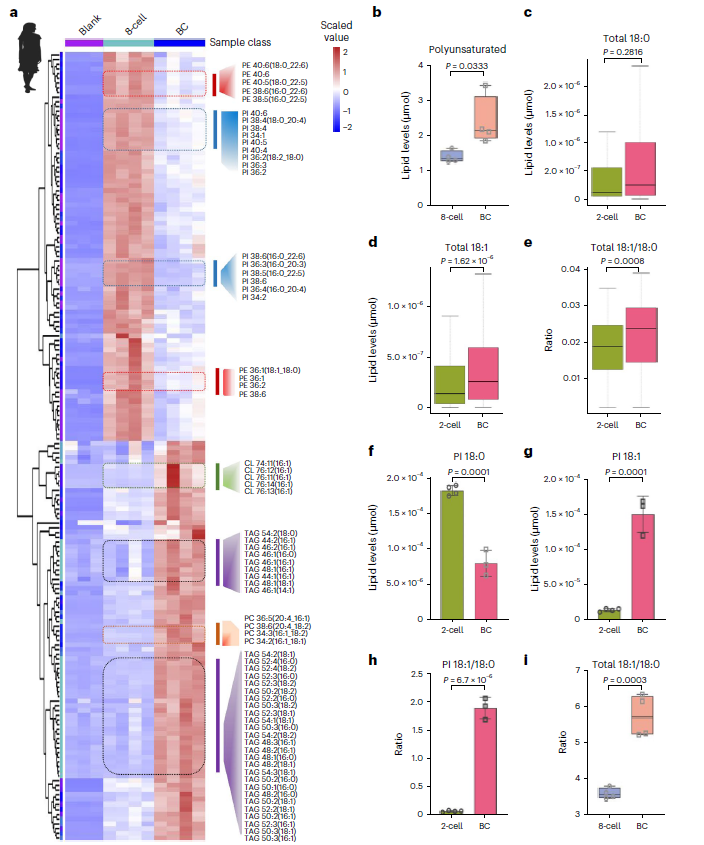
图5:在小鼠和人类胚胎植入前发育过程中,单不饱和脂肪酸水平升高
在△9的同源酶中,去饱和酶SCD1在囊胚期的表达最为丰富。因此,研究者使用SCD1抑制剂(CAY10566)处理用以确定SCD1在小鼠胚胎发育中的功能,发现经毒性浓度处理的胚胎在KSOM全培养基中培养时囊胚形成率轻度受损,囊胚腔面积减少(图6b、c)。为了排除培养基干扰,研究人员在无脂肪酸 BSA的KSOM培养基和不含BSA的培养基上进行了相同的实验。这些培养基中的囊胚形成均严重受损,形态异常明显(图6d、f),空腔面积明显减少(图6e、g)。为了排除小分子抑制剂非特异性作用的可能性,研究人员使用siRNA敲低SCD1,进一步证实了在使用SCD1抑制剂的实验中观察到的发育异常由其功能被抑制所引起(图6h、i)。同时作者还验证了SCD1敲除后,C18不饱和脂肪酸与饱和脂肪酸的比率降低(图6j、图6k)。随后,作者尝试补充油酸挽救由SCD1抑制引起的表型。结果发现,经CAY10566处理或siRNA处理的胚胎中,大多数囊胚的形态异常和发育迟缓都可以通过补充油酸来修复(图6l-o)。
为了深入了解SCD1如何影响囊胚形成,研究人员对经SCD1处理后成功达到囊胚期的胚胎进行了RNA测序分析(图6p)。分析显示内质网应激相关基因上调,结果与外源补充饱和脂肪酸可引起内质网应激的事实一致。同时发现与顶侧质膜和微管运动相关的基因被下调,提示细胞骨架组织可能在发育过程中受损。
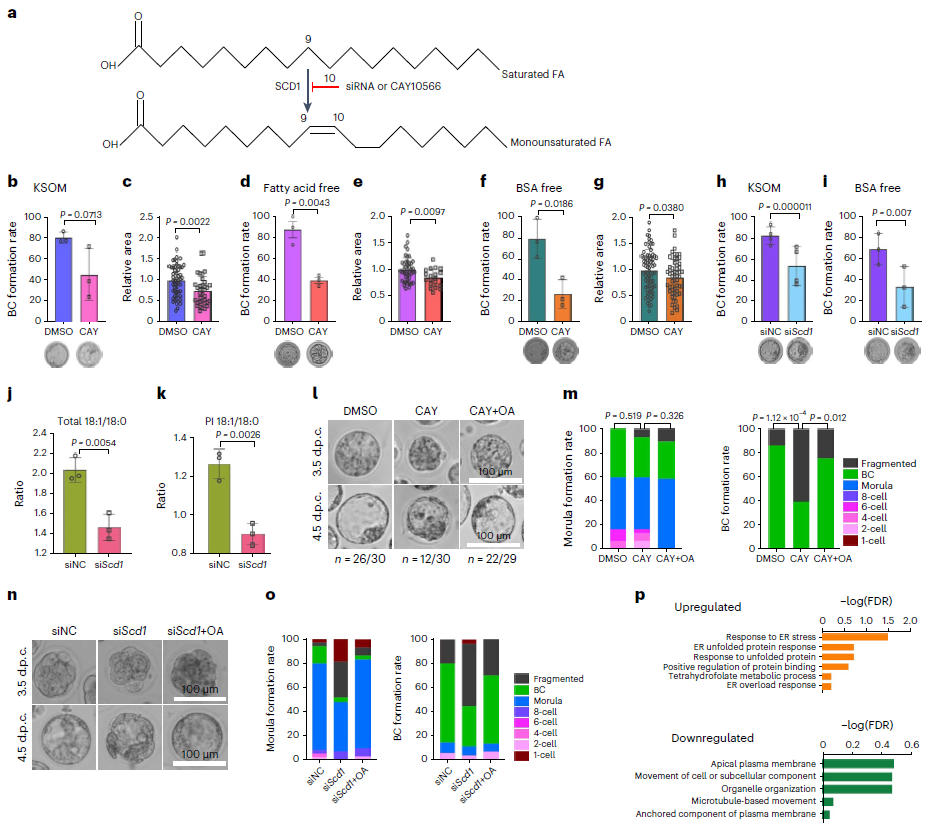
图6:脂质不饱和在囊胚发育过程中起重要作用
4、在8细胞到囊胚阶段的胚胎发育中,去饱和酶有助于膜流动性和细胞骨架组织
在受精卵发育过程中,细胞骨架蛋白如肌动蛋白微丝,微管蛋白和中间丝状体蛋白的正确组装对促进卵裂球极性的形成(即顶端结构域和基底外侧结构域的形成)是必须的,上述转录组结果提示在8细胞向囊胚发育过程中,细胞骨架的组织可能存在异常。
研究人员对早期胚胎发育全过程的质膜流动性进行观察,发现卵母细胞期后质膜流动性降低,从2细胞期到囊胚期逐渐恢复(图7a);并进一步发现SCD1抑制导致的膜流动性下降可以通过补充油酸而解救(图7b):说明SCD1通过介导单不饱和脂肪酸合成,调节脂质不饱和度而影响膜流动性。
一般认为,囊胚膜流动性的增加是胚胎表面顶端结构域的形成的基础,而这一过程需要细胞骨架成分的参与。依据RNA-Seq的结果,研究人员进一步评估脂质去饱和酶SCD1对细胞骨架组织的功能,作者选取比较典型的细胞骨架蛋白:角蛋白8 (K8)和角蛋白18 (K18) 进行了免疫荧光检测。观察到K8和K18在受精后3.5天或4.5天形成了密集的顶端区域网络。而CAY10566对SCD1的抑制破坏了K8和K18有组织的定位,使它们在胚胎表面的分布更加均匀,并导致细胞-细胞边界的信号强度下降,界面模糊。这种现象可以通过添加油酸而恢复,同时发现这种干扰不会对细胞总数产生很大影响(图7c-h)。敲除SCD1进一步巩固验证了这些结果(图7i-k),表明SCD1脂质去饱和酶有助于囊胚发育过程中细胞骨架的正常组织。
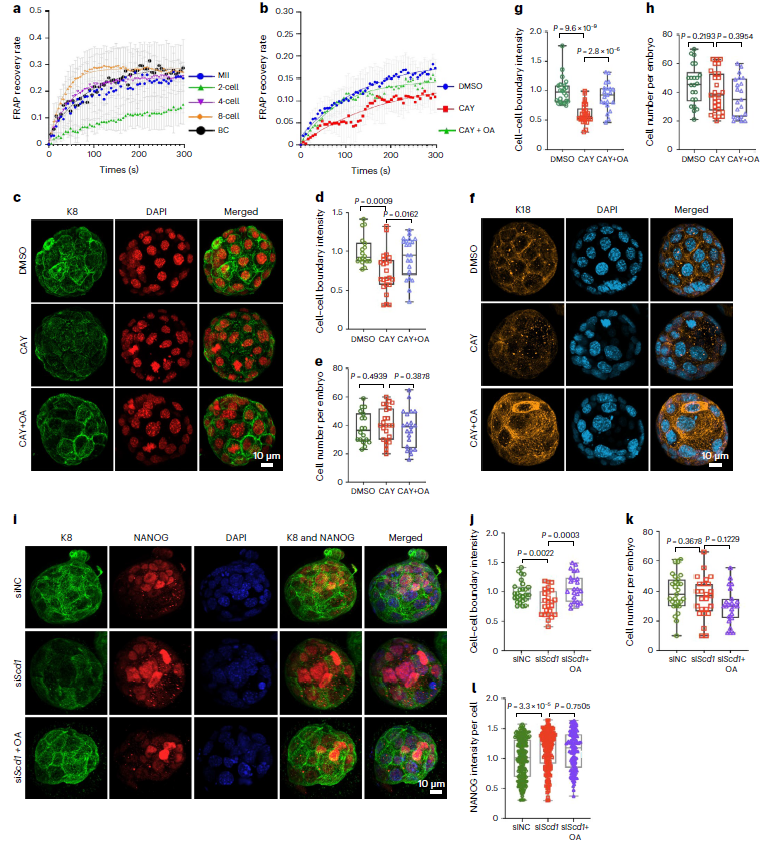
图7:在8细胞向囊胚发育的过程中,去饱和酶SCD1有助于膜流动性和细胞骨架组织
在证明单不饱和脂肪酸对囊胚发育的重要性后,研究人员基于组学结果,进一步探究了多不饱和脂肪酸对早期胚胎发育的贡献。分别用Δ5酶的抑制剂芝麻素、Δ6酶的抑制剂SC-26196对胚胎进行处理,发现两种抑制剂的处理均显著损害了囊胚的形成,并减少了腔面积(图8b-e)。同样地,作者发现用任何一种抑制剂处理都会导致细胞骨架组织破坏并使细胞-细胞边界模糊,且可以通过补充多不饱和脂肪酸PUFAs如ω-6的花生四烯酸(ARA)和ω-3的二十碳五烯酸(EPA)来挽救(图8f-i)。
综上所述,合成多不饱和脂肪酸和单不饱和脂肪酸的去饱和酶对早期胚胎发育至关重要,因为它们有助于细胞骨架的组织,这是形成顶端结构所必需的。
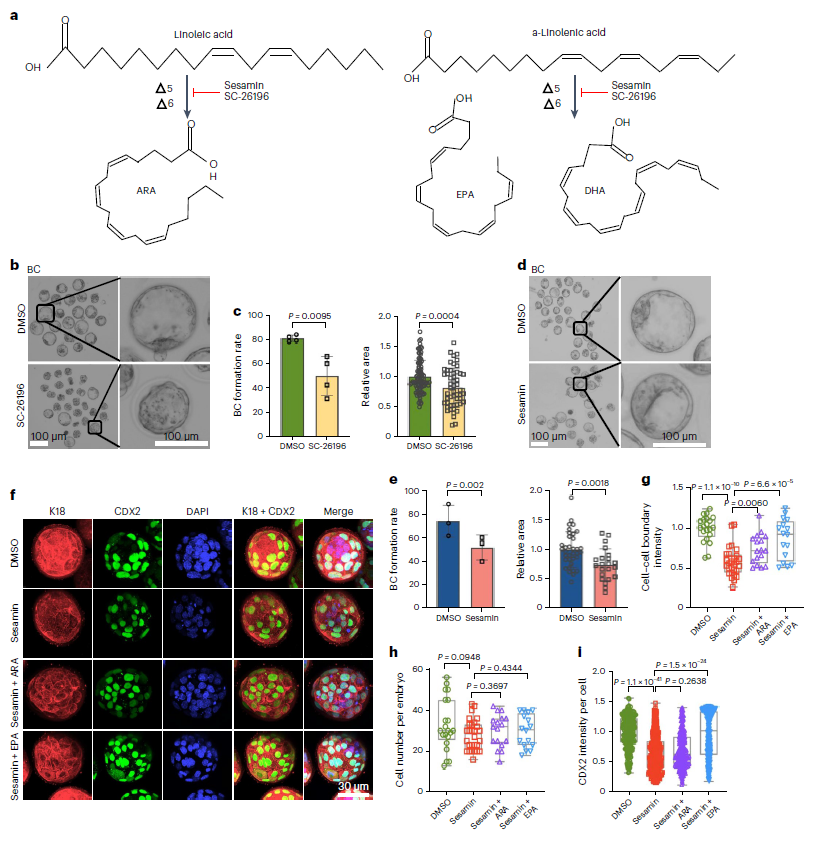
图8:合成多不饱和脂肪酸的去饱和酶通过介导细胞骨架组织和顶端结构域形成来促进囊胚形成
5、去饱和酶有助于早期胚胎的顶基极性的建立,从而使囊胚在子宫内成功着床
研究表明,在8细胞胚胎形成后,会产生卵裂球极性建立的现象,该过程是由一系列精密调控的极性蛋白(αPKC、Ezrin)、细胞骨架蛋白(K8、K18)和脂质分子(PIP2)协同完成。研究人员想要证明SCD1是否在建立顶-基底极性中是必须的,于是在CAY10566处理8细胞胚胎后,对上述蛋白进行免疫组化染色。发现8细胞胚胎顶端区域磷酸化ezrin富集减少(图9a),其在囊胚中的分布模式被破坏(图9e),同时发生总含量不同程度的下降(图9b、f)。而另一种极性蛋白αPKC在8细胞胚胎中没有变化,但在囊胚中轻度降低(图9c、g);此外,当SCD1在8细胞和囊胚中被抑制时,基底外侧蛋白E-cadherin的表达均有降低(图9d、h)。
在前文对囊胚膜流动性分析的结果中,研究人员确定对SCD1的抑制会导致膜的流动性下降。在顶基底极性形成中,有Ezrin和Actin两种比较重要的蛋白。而在对其流动性进行评估后发现:二者流动性在CAY10566处理后减弱,在添加油酸后恢复(图9j、k),提示SCD1介导的脂质单不饱和度,通过影响极性蛋白流动性,调控骨架蛋白的正确分布,保证胚胎发育正常进行。
由于顶基极性同时能够促进滋养层细胞特化,研究人员检测了TE转录因子YAP的表达,发现在SCD1抑制的囊胚中,YAP的细胞核表达减少,TE细胞的特化受损(图9e、i)。在此基础上,作者将SCD1下敲的胚胎移植进假孕母鼠体内(图9l),与对照组相比,SCD1抑制组胚胎的着床率下降,蜕膜数目减少(图m、n),孕E7.5天时,胚胎外标记物K18的表达也减少(图9o)。这些结果提示SCD1参与调节8细胞到囊胚发育过程中顶基极性建立的分子事件,对囊胚在子宫内正常着床有重要作用。
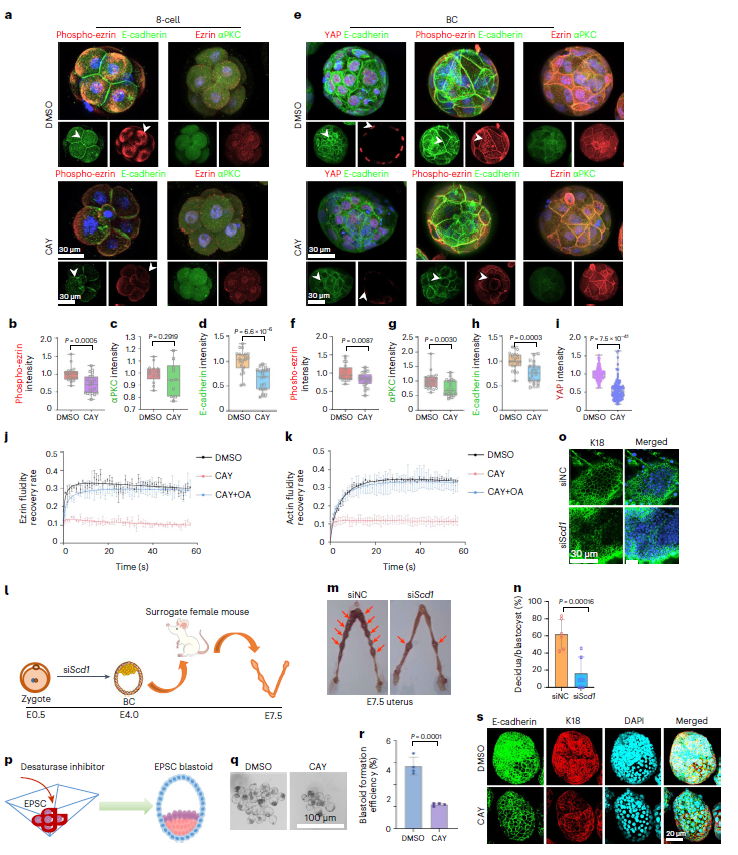
图9:去饱和酶有助于早期胚胎的顶基极性的建立,从而使囊胚在子宫内成功着床
6、去饱和酶有助于小鼠胚胎干细胞的囊胚生成
由于小鼠囊胚由ICM和TE细胞系组成,研究人员分别检测了体外培养的小鼠胚胎干细胞(ESCs)和滋养细胞干细胞(TSCs),以观察顶基上皮极性形成和细胞骨架组织是否受到脂质不饱和的影响。在前文三种不饱和脂肪酸合成酶抑制剂的分别处理下,两种细胞系均出现与上文经抑制剂处理的小鼠胚胎类似的表现。鉴于囊胚的自然形成和诱导多能干细胞分化成仿自然囊胚的过程高度相似,研究人员尝试探究在诱导囊胚建立过程中是否需要增加脂质不饱和度。于是在诱导培养基中抑制去饱和酶的活性,并诱导干细胞产生囊胚(图9p,图10a)。与对照细胞相比,添加抑制去饱和酶活性培养基的胚泡样结构形成效率降低(图9q、r,图10b、c)。在使用不饱和脂肪酸酶抑制剂干扰时,也得到了相同的表型(图10d)。这些实验更进一步证明了脂质不饱和度的增加对胚胎细胞极化和囊胚的形成是非常重要的。
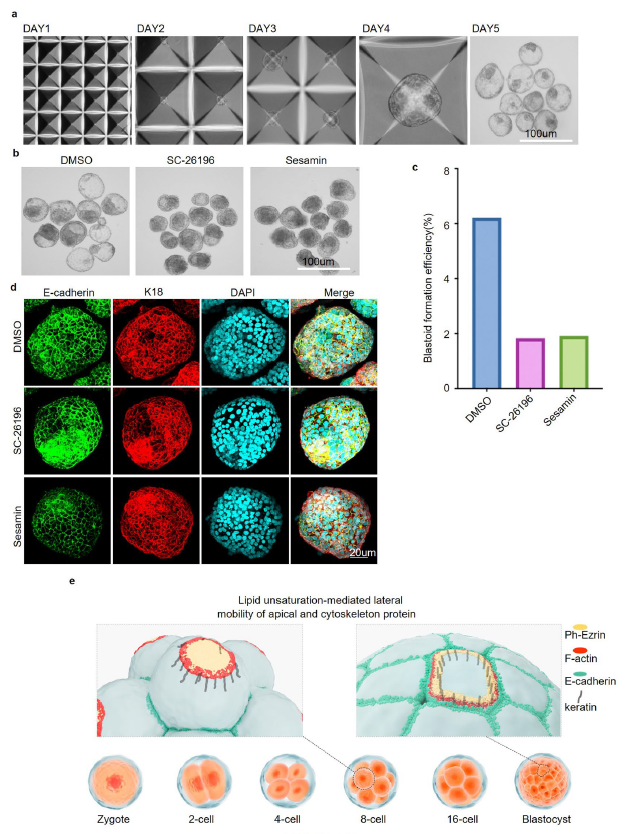
图10:合成单不饱和脂肪酸和多不饱和脂肪酸的去饱和酶是生成类囊胚所必需的
总结与展望
本文首次描绘了哺乳动物着床前胚胎发育的动态脂质景观,揭示每个发育阶段具有其独特的脂质组学特征,为发育过程中脂质代谢的研究打开了新的思路。技术上,利用MS-based的超灵敏靶向代谢组学和少量胚胎脂质组学技术,可实现较低细胞输入量的高精度脂质测量。同时,使用了两种互补的脂质提取方法保障了结果的可信性。全局脂质组学所揭示的胚胎早期发育大规模脂质重塑引人入胜,但仍有许多未阐明的变化有待研究。该文发现不同时期胚胎均具有特征性的脂质簇,可以作为“脂纹”图谱,为无创评估胚胎质量和发育潜力提供了一些新的思路。
原文链接:
https://www.nature.com/articles/s41556-023-01341-3
小编:蔡悦然
参考文献:
1.Dunning KR, et al. Beta-oxidation is essential for mouse oocyte developmental competence and early embryo development. Biol. Reprod. 83:909–918 (2010).
2.Chi, F., et al. Glycolysis-independent glucose metabolism distinguishes TE from ICM fate during mammalian embryogenesis. Dev. Cell 53, 9–26.e24 (2020).
3.Conesa, A., et al. maSigPro: a method to identify significantly differential expression profiles in time-course microarray experiments. Bioinformatics 22,1096–1102 (2006).
4.Lim, H. Y. G. et al. Keratins are asymmetrically inherited fate determinants in the mammalian embryo. Nature 585, 404–409 (2020).
5.Lim, H. Y. G. & Plachta, N. Cytoskeletal control of early mammalian development. Nat. Rev. Mol. Cell Biol. 22, 548–562 (2021).



