Nature:RANK 驱动妊娠期结构性肠上皮扩张
研究背景
妊娠是一种重要的短暂生理状态,妊娠期母亲为适应子代的最佳存活和生长,身体会发生不同程度的适应性生理变化[1]。这种适应性变化在进化尺度上是相当保守的,存在于多种可繁殖物种中,包括昆虫和哺乳动物[2-4]。虽然这种适应事件对母亲和后代的健康至关重要,但妊娠过程中发生的许多母体重塑机制目前尚不清楚。胎儿的营养由母体供给,妊娠增加了母亲对于营养高吸收效率的需求。小肠作为营养吸收的主要器官,其充分适应性变化可以确保发育中胎儿的代谢需求。先前的研究发现,大鼠在怀孕期间观察到小肠黏膜上皮重量的增加[5]。
RANKL及其受体RANK具有广泛的生理功能,其对破骨细胞的发育和活化至关重要,在骨重塑中具有关键作用[6]。此外,RANK–RANKL还调节淋巴结器官形成、胸腺髓质上皮细胞的发育、中枢体温调节、以及怀孕期间泌乳乳腺的形成[7-10]。而参与生殖的炎症细胞因子和激素,如催乳素和孕酮可以强烈诱导RANKL的表达[11, 12]。除此之外,RANK-RANKL系统也在肠道中发挥作用,是派氏结M细胞分化所必需的[13]。在本研究中,作者揭示了RANK和RANKL是妊娠和哺乳期间肠干细胞和肠上皮扩张的调节剂,在妊娠期调节母体的肠道生理适应。
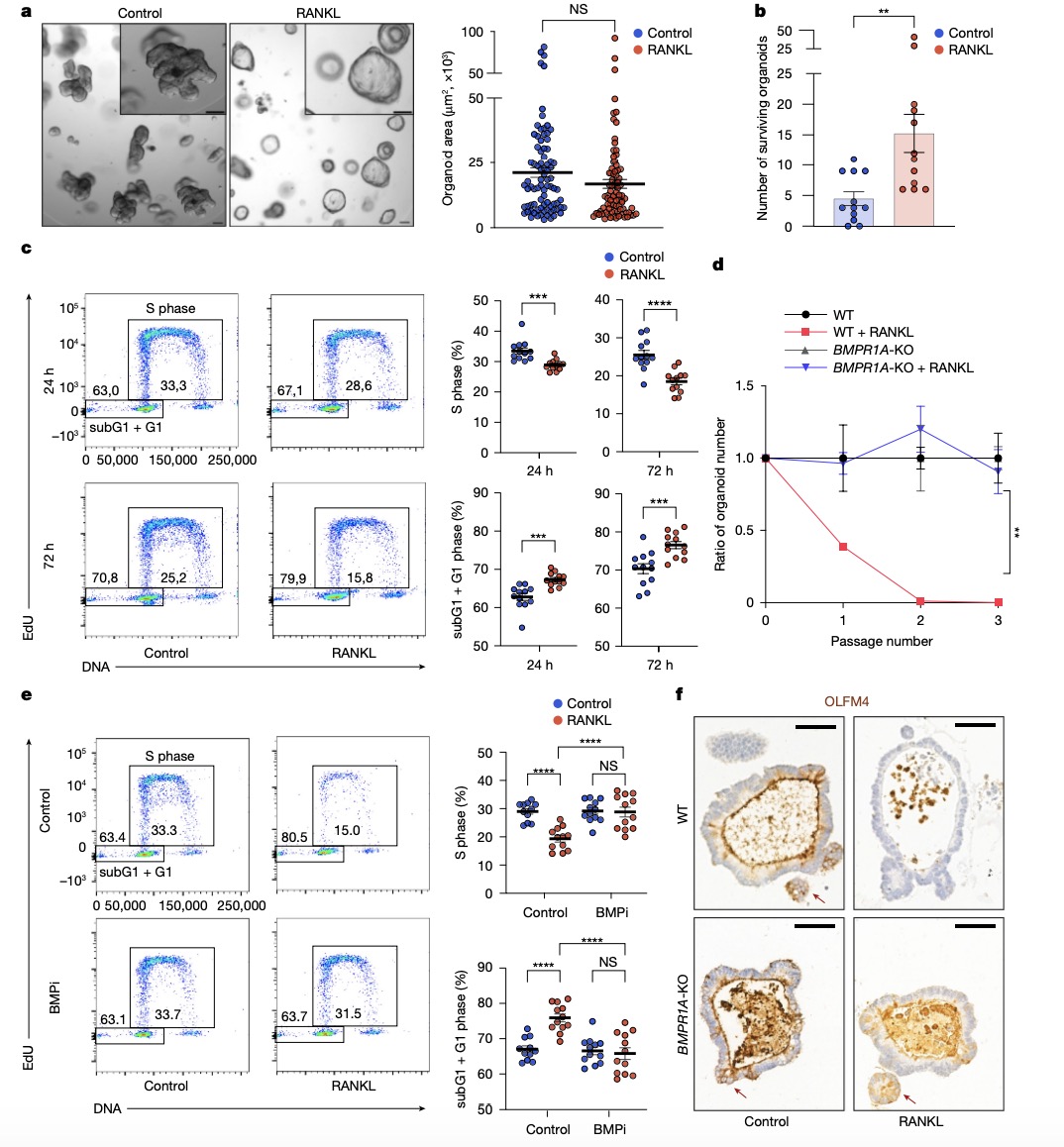
研究内容 1. RANK-RANKL控制体外肠道类器官的扩张增殖和干性减弱 作者首先通过小鼠肠绒毛RANK 和 EPCAM荧光共染发现,几乎所有小鼠肠上皮细胞表达RANK,包括分化的肠细胞和干细胞,除了位于绒毛顶部的上皮细胞(图1a左)。为了探究RANK是否在肠上皮中具有功能性作用,作者将小鼠空肠类器官暴露于RANKL,发现其促进了类器官的生长。但第3天左右,类器官样芽的数量减少,并且观察到异常的出芽伸长(图1b)。类器官的芽数与功能性干细胞有关,免疫荧光发现,RANKL持续刺激导致Lgr5-eGFP+CD44+和OLFM4+干细胞的显著减少(图1c,d)。两组类器官bulk RNA-seq显示,RANKL刺激导致NF-κB途径的激活和多种抗凋亡基因的诱导,还导致BMP和MAPK–ERK通路的上调。随后作者对两组类器官scRNA-seq发现,小鼠空肠类器官存在9个不同的上皮细胞分群,抗凋亡基因的上调出现在干细胞、转运扩增(TA)细胞和吸收性肠细胞中(图1e),并且RANKL刺激组的类器官对辐射损伤表现出增强的存活率(图1f)。Bmp2的显著上调主要在成熟和未成熟肠上皮祖细胞中观察到;Bmp2调节的靶基因Id2和Id3在干细胞、TA细胞和吸收性肠细胞中显著上调(图1g)。为了确定Bmp2的上调是否是RANKL组类器官干性减弱的原因,作者采用Bmp受体阻断剂LDN-193189 (BMPi)和NOGGIN治疗RANKL刺激的类器官,改善了RANKL处理的类器官的干细胞衰竭表型(图1h),并且NOGGIN的改善作用表现为剂量依赖方式(图1i)。 图 1:RANK-RANKL控制体外肠道类器官的扩张和干性减弱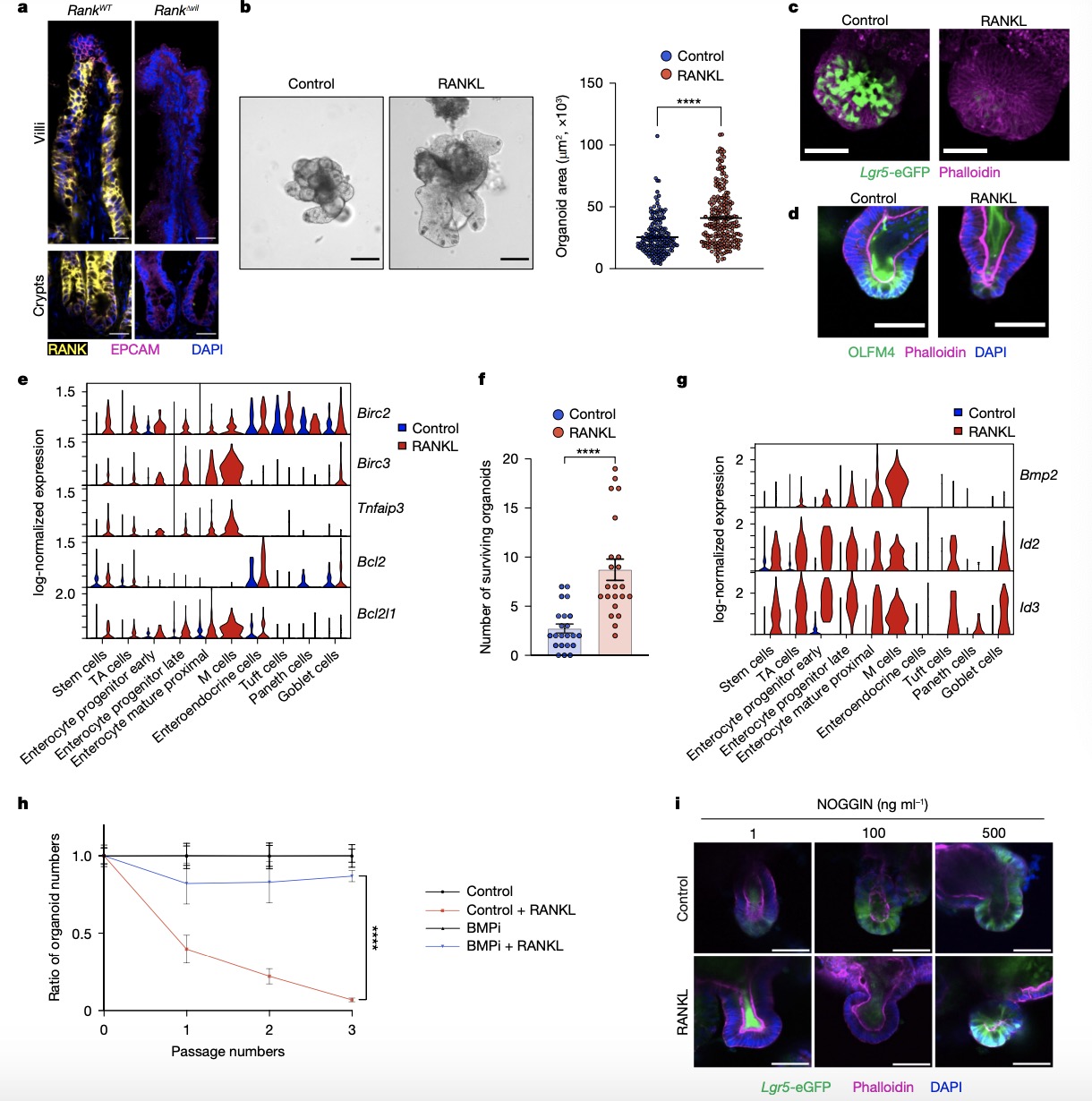
2. RANK组成型激活促进小鼠体内的绒毛扩张和干细胞耗竭 为了研究RANK激活是否会导致体内的肠上皮增殖和干细胞耗竭,作者采用caRANKvil-Tg转基因小鼠,该小鼠在肠上皮中条件性表达激活突变的RANK。与体外类器官一致的是,3周龄的caRANKvil-Tg小鼠表现出小肠绒毛的显著扩张(图2a),随后在5-8周龄的转基因鼠中观察到OLFM4+肠干细胞数量的减少和绒毛长度的减少(图2b、c)。为了进一步探索潜在的机制,研究者们从caRANKvil-Tg小鼠构建空肠类器官。与RANKL刺激的类器官一致,RANK的组成型激活导致增强的器官样生长,然而又减少了类器官样芽的数量,并存在干细胞维持的受损。随后作者评估了NF-κB信号传导在体内RANK功能中发挥的作用。结果发现,在caRANKvil-Tg小鼠的肠上皮细胞中观察到磷酸化IκB(NF-κB抑制剂)的大量上调,表明NF-κB信号传导被激活,并且添加NF-κB抑制剂sc-514可以改善RANK驱动的BMP通路和抗凋亡基因表达,表明NF-κB是RANK下游的关键信号通路。TRAF6是将RANK与NF-κB活化偶联的一个关键分子接头,将Traf6floxed与Villin1-cre小鼠杂交得到肠细胞特异性敲除Traf6的小鼠,肠上皮细胞中Traf6的缺失增加了OLFM4+干细胞的数量,老年caRANKvil-Tg小鼠中观察到绒毛长度减少的现象得到恢复(图2d、e)。 鉴于RANK的肠道干细胞耗竭作用,作者探究了组成型活性RANK能否调节由Apcmin功能丧失突变诱导的异常肠道干细胞扩增和腺瘤发生。APC作用于WNT的下游,Apcmin突变驱动异常的WNT激活,导致小鼠肠道细胞不受控制的增殖和肠腺瘤性息肉病。研究者们将caRANKvil-Tg小鼠与Apcmin/+小鼠杂交,结果发现子代caRANKvil-Tg Apcmin/+小鼠中腺瘤的数量和大小相比Apcmin/+小鼠出现下降(图2f),体内组成型活性RANK抑制Apcmin突变体肠干细胞肿瘤的生长。并且,来自Apcmin/+小鼠的肿瘤类器官仍然对RANK-RANKL驱动的干性衰竭表型敏感(图2g)。 图 2:RANK的组成型激活促进小鼠体内的绒毛扩张和干细胞耗竭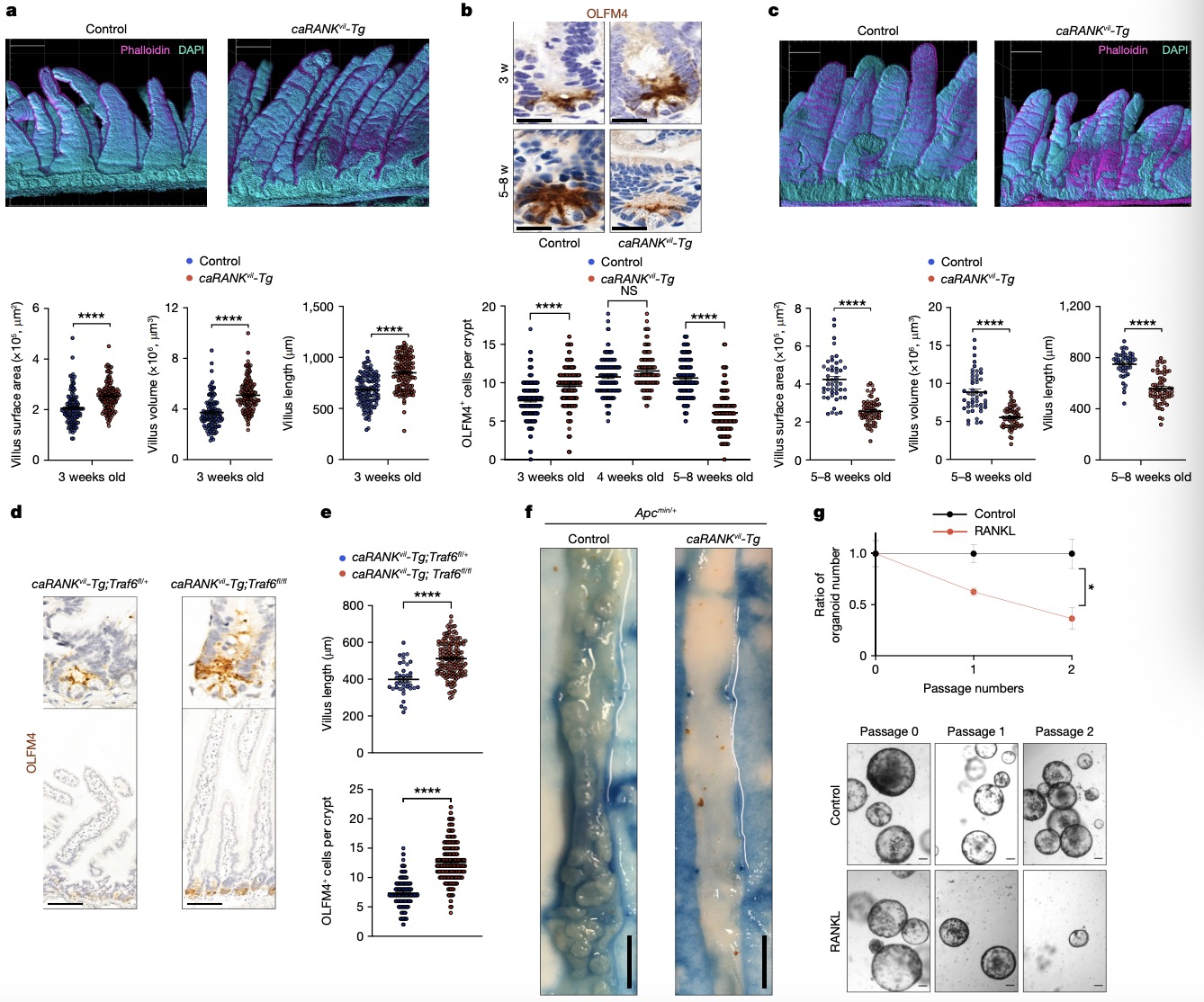
3. RANK控制妊娠和哺乳期的肠道扩张 鉴于母亲在妊娠期的生理剧变,以及生殖相关激素催乳素和孕酮对RANKL的诱导作用,作者探究了RANK信号在小鼠妊娠过程中肠道适应变化中的作用。作者首先研究了妊娠期和哺乳期小鼠肠绒毛的变化。在妊娠晚期,特别是哺乳期野生型小鼠的肠绒毛明显变大(图3a)并在排除肠道微生物组后仍然发生了肠道上皮扩张(图3c)。而在出生后第1天移除子代以停止泌乳,导致母亲体内的绒毛变小(图3d);并且泌乳素抑制剂卡麦角林治疗哺乳期小鼠,也导致哺乳期母鼠肠绒毛减小(图3e),表明催乳素参与控制哺乳期小肠的扩张和停止泌乳后的肠道退化。 为了评估Rank驱动的绒毛扩张在肠道稳态中的生理作用,作者建立了肠道上皮特异性RANK敲除的Rank∆vil小鼠模型,肠RANK的表达在Rank∆vil小鼠中消失(图1a)。在未产仔Rank∆vil小鼠中,绒毛形态不受Rank缺失的影响,OLFM4+肠干细胞的数量也没有变化(图3a、b)。而妊娠晚期和哺乳期Rank∆vil小鼠中小肠绒毛的扩张明显受到抑制(图3a),并且肠上皮细胞中Traf6的缺失复现了Rank缺失导致的哺乳期母鼠肠道受损的上皮扩张(图3f)。免疫组化显示,相比对照组,哺乳期Rank∆vil组小鼠小肠上部有更多的肠干细胞,并在断奶后返回到无差异的非妊娠基线(图3b)。表明RANK信号缺失导致小鼠肠绒毛增殖分化受阻,RANK-RANKL及其下游TRAF6信号参与了妊娠和哺乳期间肠上皮适应的分子途径。 图 3:RANK信号控制妊娠和哺乳期的肠道扩张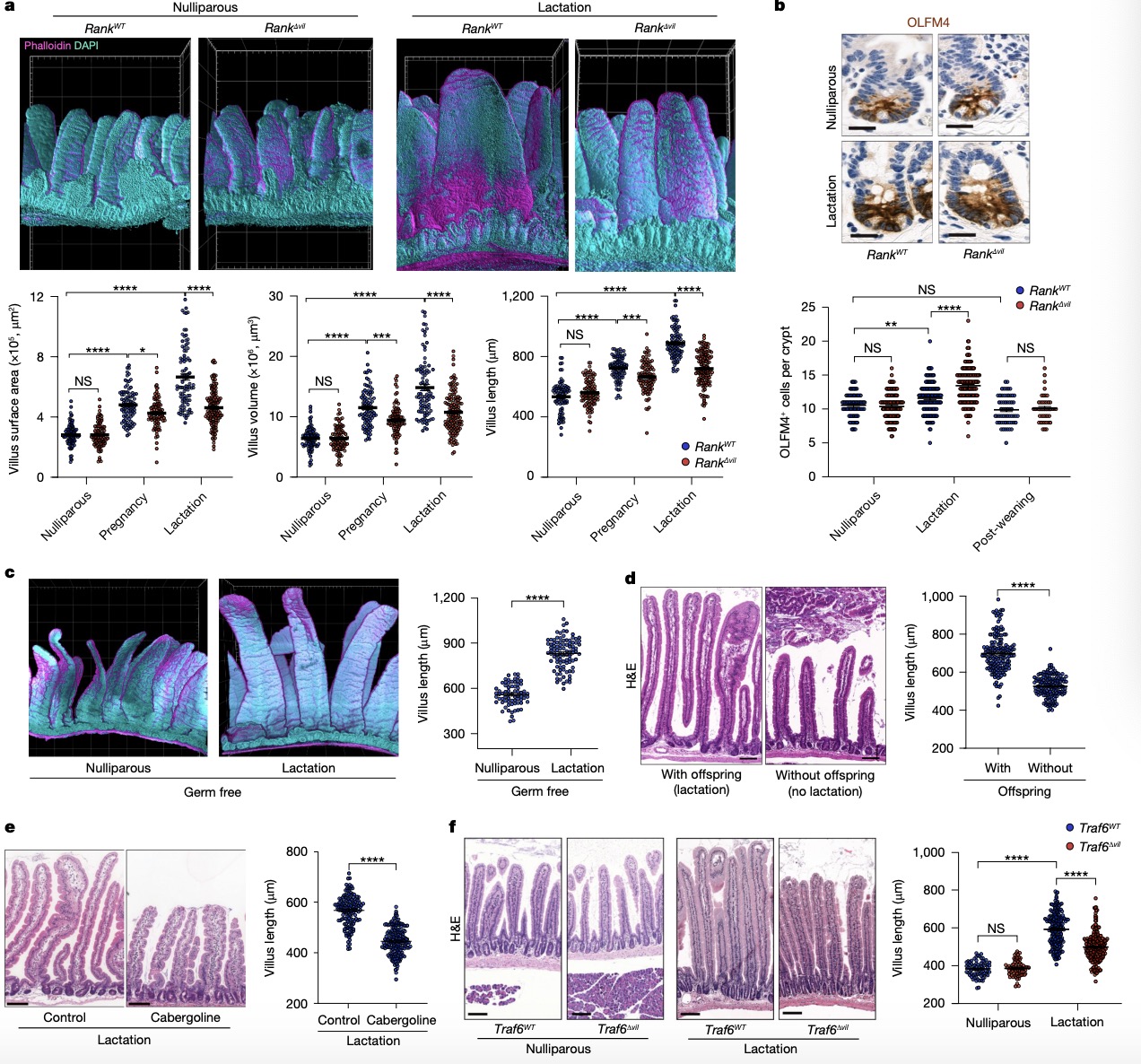
4. 肠道RANK信号缺失对子代的影响 研究者收集了两组哺乳期小鼠乳汁,Rank∆vil小鼠乳汁相比对照组,多种脂肪酸、甘油三酯和脂溶性维生素A的含量降低,而氨基酸和亲水性维生素B1、B2和B4的含量正常(图4a),并观察到IgA显著减少,而IgG没有差异。表明母鼠肠上皮中RANK的确实导致哺乳母亲乳汁中的代谢和免疫改变。并且在胚胎第18.5天(E18.5),Rank∆vil小鼠胚胎已经表现出显著的较低体重。同样地,在出生时,Rank∆vil小鼠子代表现为低出生体重;子代在出生后,尤其是在哺乳期相比对照子代体重较低,并且在一生中保持较小体重(图4c)。将两组子代暴露于高脂肪饮食(HFD)后,在Rank∆vil小鼠子代观察到糖耐量受损、空腹血糖升高和胰岛素抵抗(图4d–f)。 图 4:肠道RANK信号缺失对母鼠乳汁和子代的影响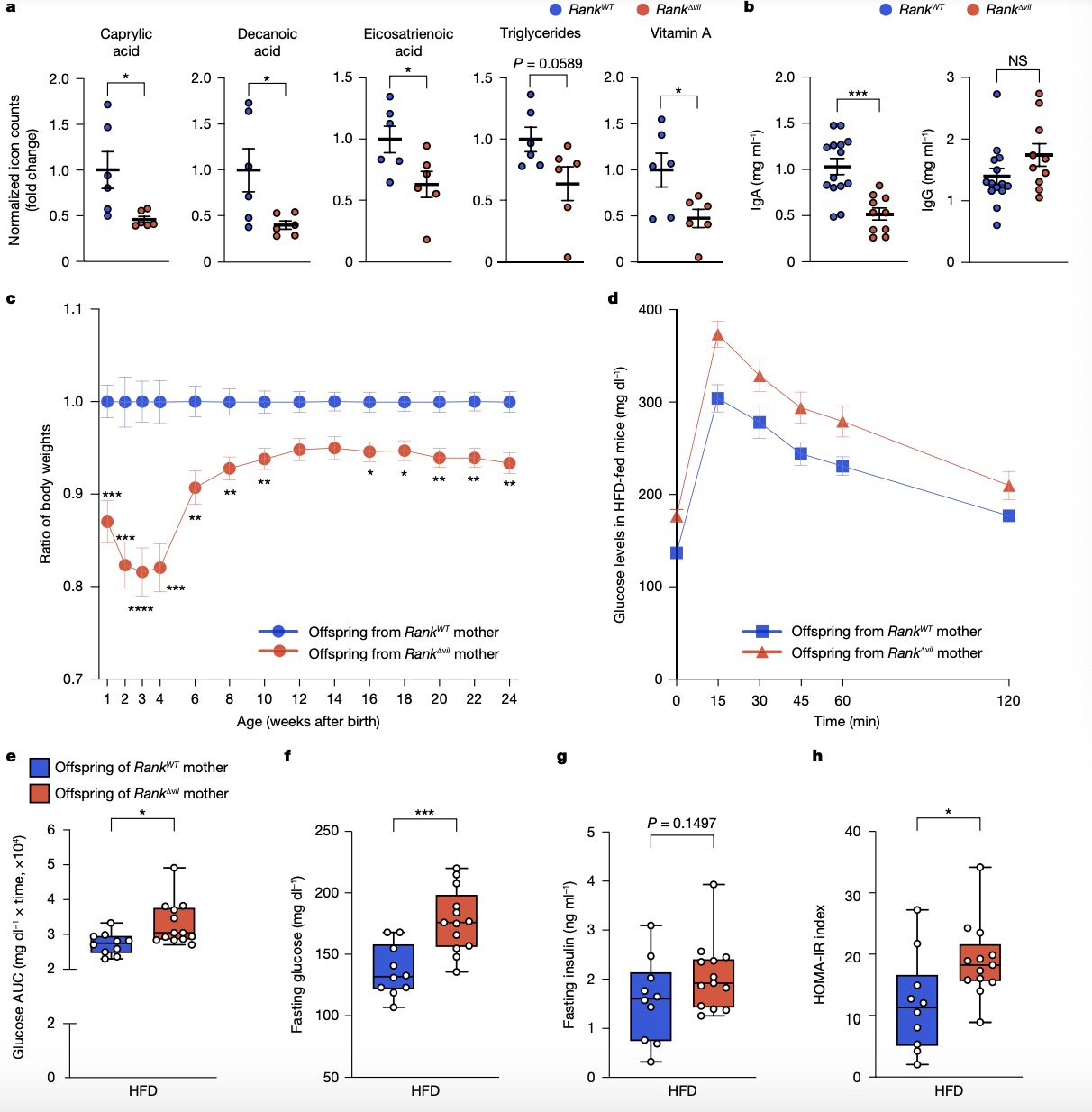
5. RANK–RANKL调节人类小肠类器官的增殖和干性衰竭 随后作者研究了RANK介导的肠上皮扩张和干性丧失是否也发生在人类中。从健康女性分离培养十二指肠样类器官,RANKL刺激确实引发了类器官的形态学变化(图5a)。并且与小鼠的抗凋亡信号的上调一致,RANKL处理促进了这些人的肠类器官辐射后的细胞存活。并且RANK刺激后也影响类器官的细胞增殖(图5c)、生长停滞和干性丧失(图5d)。同样地,能够使用BMP受体阻断剂LDN-193189(BMPi)挽救RANK诱导人类类器官的OLFM4+干细胞减少和增殖缺陷。而将BMPR1A敲除的人类肠道类器官暴露于RANKL,BMP信号通路的抑制完全阻断了RANK驱动的生长停滞和OLFM4+干细胞衰竭(图5d,f)。这说明RANK–RANKL以和小鼠同样的机制调控人类肠道类器官的增殖扩张和干性衰竭。 图 5:RANK–RANKL调节人类小肠类器官的增殖和干性衰竭 总结与展望 母亲如何适应妊娠的需求仍然是人类健康的核心问题。在怀孕和哺乳期间,激素动态变化影响着多个器官,从而控制和改变它们的形态和功能,这对母亲的健康和后代的发育至关重要,但我们对这种短暂适应性生理改变背后的机制知之甚少。作者通过体外类器官培养和转基因小鼠模型,研究了RANK-RANKL信号抑制肠干细胞的自我更新并促进分化和肠道绒毛扩张;并发现在妊娠期间,RANK信号由催乳素驱动可逆地在肠道发挥作用,使母亲对怀孕期间增加的营养需求做出反应,为妊娠期母亲的肠道适应性改变和妊娠期代谢性疾病机制提供了新的思路。 原文链接: https://www.nature.com/articles/s41586-024-08284-1 小编:董凯旋