Adv Sci:细胞质RNA结合蛋白ZAR1/2调控的表观遗传修饰:高龄卵母细胞质量维持新机制
现代社会的发展和医疗技术的进步使得人类平均预期寿命显著延长。由于生活方式改变和经济压力增加,越来越多女性选择推迟生育,生殖高龄化正在成为一个全球性的社会问题。然而,值得注意的是,女性生殖能力往往在35岁左右便开始衰退,自此体内可使用卵母细胞的数目逐渐下降、发育潜能及其表观遗传修饰稳态也随之出现紊乱。尽管如此,目前对于这一过程的具体调控机制仍了解有限。
近年来,多种组织器官中的研究显示,表观遗传信息的丢失,而非基因突变,是导致衰老的主要原因。女性在出生时已经携带了一生所需的全部卵母细胞并以休眠状态储存在卵巢中,因此表观遗传信息的正确建立和长久维持对于卵母细胞尤为重要。瞬时或长期积累的环境信号在染色质状态上的整合必将影响卵母细胞的基因表达及其下游细胞学事件【1】。由于卵母细胞表观遗传修饰持续存在,并且随年龄增长而逐渐变化,可根据表观遗传修饰建立和维持的情况来评估卵母细胞质量【2】。
另一方面,由多种母源因子介导的包括mRNA的运输、储存、编辑、翻译、降解等在内的RNA转录后调控,对于卵子发育潜能的建立至关重要。合子停滞因子1(Zygotic arrest 1,ZAR1)是最早报道的哺乳动物母源效应基因之一,在本世纪初被发现,其突变导致受精卵发育阻滞在合子阶段【3】。ZAR1及其同源基因ZAR2在所有脊椎动物的卵母细胞中特异性并且非常丰富地表达,但是它们所介导的具体生化事件一直众说纷纭。而且以往研究主要聚焦于ZAR1/2在卵子成熟和受精卵发育中的功能【4】,并未探究这两个重要母源因子在女性生育力维持中的作用。
近日,浙江大学医学院附属邵逸夫医院、全省生育力精准保护与促进重点实验室范衡宇团队和张松英团队合作在Advanced Science杂志上在线发表了题为ZAR1/2-regulated Epigenetic Modifications are Essential for Age-associated Oocyte Quality Maintenance and Zygotic Activation的研究成果,报道了ZAR1/2这两个具有互补作用的明星母源因子在高龄卵母细胞表观遗传成熟及合子重编程中的重要新功能。

该研究团队曾于2019年在Nucleic Acids Research杂志上报道了ZAR1/2在卵母细胞中调控mRNA稳定和翻译活性、促进卵子核质成熟的机制研究【5】。近期,他们在延续性工作中进一步发现,ZAR1/2母源性缺失的小鼠卵母细胞和受精卵中包括H3K27me3、H2AK119ub1、H3K9me3、H3K27ac、H3K9ac、H3K4me2/3和H4K5/8/12/16ac在内的多种组蛋白修饰水平下降(图1),及相应修饰因子的水平下降,并表现出卵胞质中颗粒沉积、线粒体分布异常、卵母细胞成熟缺陷、发育潜能丧失等卵子提前老化的典型征兆。另一方面,高龄的小鼠/人卵母细胞表现出与ZAR1/2缺失小鼠卵母细胞相似的组蛋白修饰和修饰因子缺陷,且ZAR1/2转录本和蛋白水平均减少,高龄小鼠卵母细胞中回补ZAR1/2可挽救RNF2及H2AK119ub1不足的缺陷,提示ZAR1/2对生殖衰老中的表观遗传修饰具有调控作用。这些发现首次把RNA结合蛋白ZAR1/2的功能与卵子表观修饰的建立和维持、以及高龄女性卵子质量下降联系了起来,也激发研究团队进行了后续的机制研究。
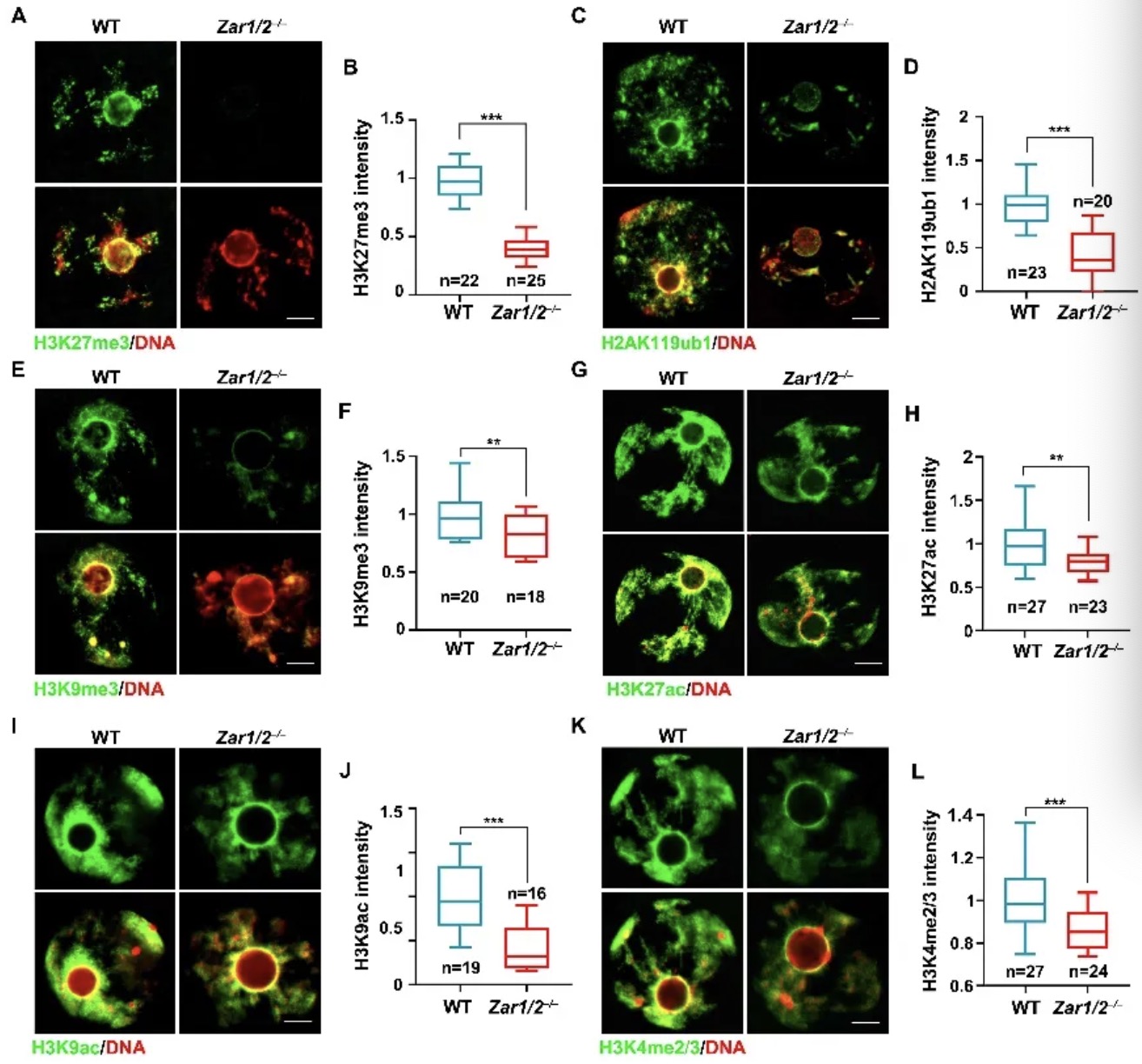
图1:ZAR1/2缺失的GV期小鼠卵母细胞中多种组蛋白修饰水平下降
已知ZAR1与多种RNA结合蛋白一起,把母源mRNA募集和储存在一个被称为“MARDO”的线粒体相关核糖核酸蛋白结构域中。而与ZAR1互作的MARDO另一成分MSY2缺失的小鼠卵母细胞中,也具有类似的表观修饰水平下降情况[6, 7]。进而,研究团队利用ZAR1互作RNA测序(LACE-seq)、 ZAR1互作RNA免疫共沉淀(RIP)、mRNA翻译报告系统(3’-UTR reporter)等实验,证实胞质定位的ZAR1/2通过结合编码组蛋白修饰因子的转录本并调控其稳定和翻译活性,进而参与细胞核内的表观遗传成熟建立。ZAR1/2缺失导致卵母细胞中组蛋白修饰因子转录本和蛋白水平积累不足,影响受精后的表观重塑。染色质可及性基因组测序(ATAC-seq)及组蛋白掺入实验结果也进一步表明,伴随着表观修饰紊乱,ZAR1/2母源性缺失的小鼠卵母细胞和受精卵染色质可及性下降,卵母细胞受精后初级合子基因组激活失败,影响胚胎发育和质量。
本研究提出了一种胞质RNA结合蛋白拮抗卵母细胞表观遗传衰老的细胞“质-核互作”新机制,揭示了以ZAR1/2为关键节点的“卵胞质成熟”与卵细胞核内“表观遗传成熟”相互协调的联动网络,及其在年龄相关的卵母细胞质量维持和早期胚胎发育启动中的重要作用,为经典母源效应基因的功能研究开辟了新的发展空间,也为生殖衰老导致的卵子和胚胎发育缺陷诊断及临床干预提供了潜在基因靶点。
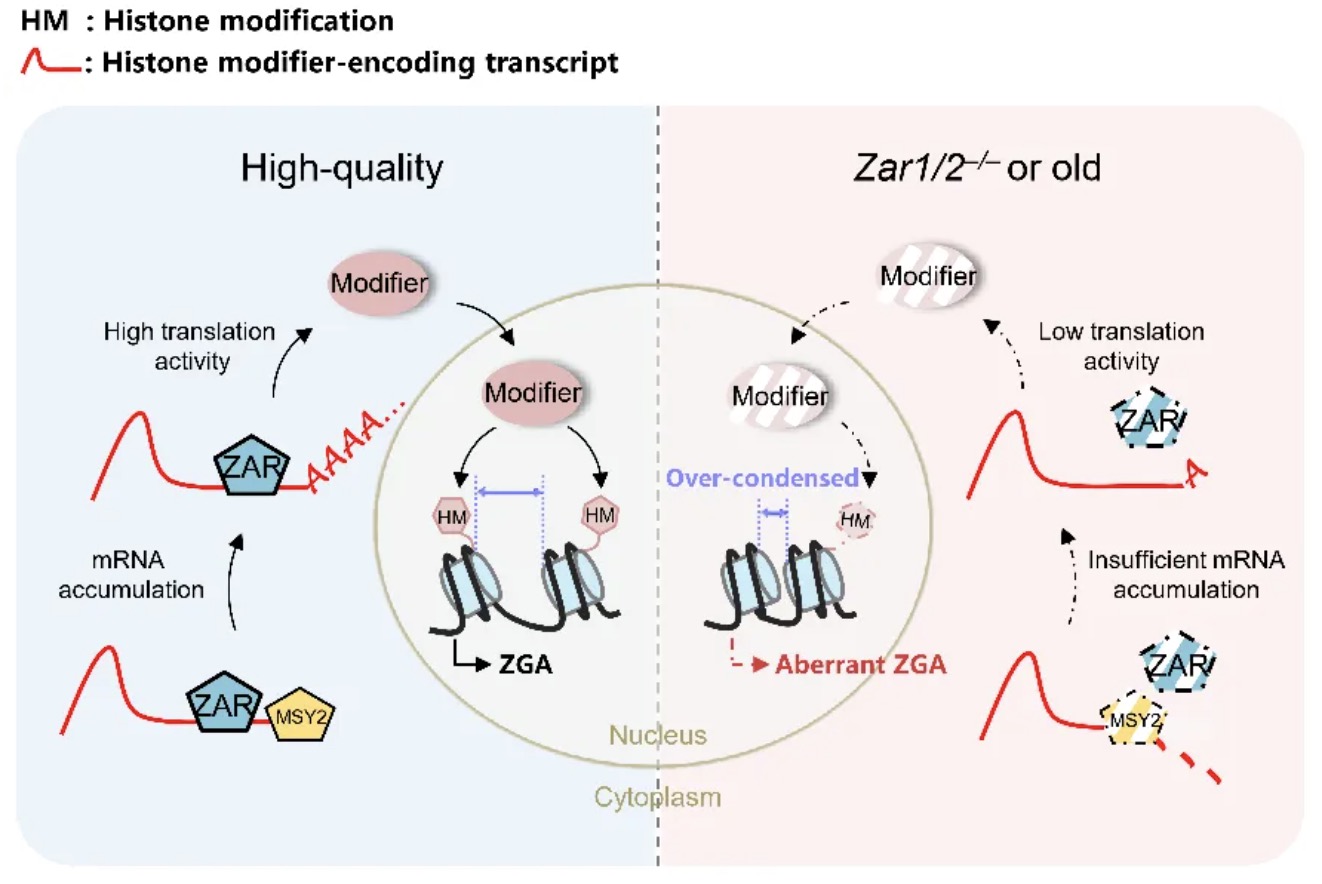
图2:胞质定位蛋白ZAR1/2介导核内表观遗传成熟建立示意图
在这项合作研究中,浙江大学医学院附属邵逸夫医院张松英教授、生命科学研究院范衡宇教授为该研究论文的通讯作者,浙江大学医学院附属邵逸夫医院特聘副研究员戎妍、浙江大学生命科学研究院博士研究生吴雨珂、浙江大学医学院附属邵逸夫医院博士研究生陈颖妍、浙江大学医学院附属邵逸夫医院青年医生刘青为该文共同第一作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202410305



