Nature:父亲高脂饮食通过诱导精子线粒体RNA表观遗传改变影响后代健康
研究背景
越来越多的研究提示,父亲的不良饮食习惯可能导致精子发生表观遗传改变,遗传给后代,增加子代发生代谢紊乱的风险。但父亲的饮食习惯主要干扰精子发生与成熟过程的哪一阶段,又通过何种机制影响子代健康,目前仍不清楚。2024年7月,德国纽伦堡环境卫生研究中心的R. Teperino研究团队在Nature杂志在线发表题为Epigenetic inheritance of diet-induced and sperm-borne mitochondrial RNAs的研究文章。该研究证实父亲高脂饮食通过诱导精子线粒体mt-tRNA发生表观遗传改变,进而影响后代健康。 除了孟德尔遗传,父系亦依赖其他途径进行跨代信息传递,比如将储存在精子中的易受环境影响、动态表达的小非编码RNA(small non-coding RNAs,sncRNAs)[1],在受精时传递给卵子[2],进而影响胚胎发育和成年表型[3-6]。 成熟精子的发育包括生精小管的精子形成(小鼠中35天)和附睾中精子的成熟(小鼠中7天)[7],这两个时期是精子表观遗传组易受到影响的窗口期。目前,普遍接受精子由附睾外泌体获得外源小RNA参与介导父系获得性表观遗传的理论[8,9],因此推测环境可能主要影响附睾精子。另一方面,尽管存在血睾屏障[10],对于精子发生过程的干扰也具有代际或跨代遗传的效应[11,12]。同时,父亲超重对后代代谢健康有影响,但相关机制尚不明确。目前现有研究主要集中于长期高脂喂养的小鼠模型,通常于小鼠4-9周龄起连续高脂喂养6-22周[13-16],这些研究没有考虑到精子发生的时间,子代结局是睾丸和附睾中精子表观遗传改变的效应叠加,不能很好地区分出高脂饮食暴露影响精子表观遗传的窗口期。因此,本研究旨在探讨精子发育成熟过程对环境的敏感性,剖析精子发生及附睾成熟对父亲代际效应的相对贡献,明确精子中特定RNA的来源及其在代际遗传中的作用,阐明父系健康对后代代谢的影响机制。
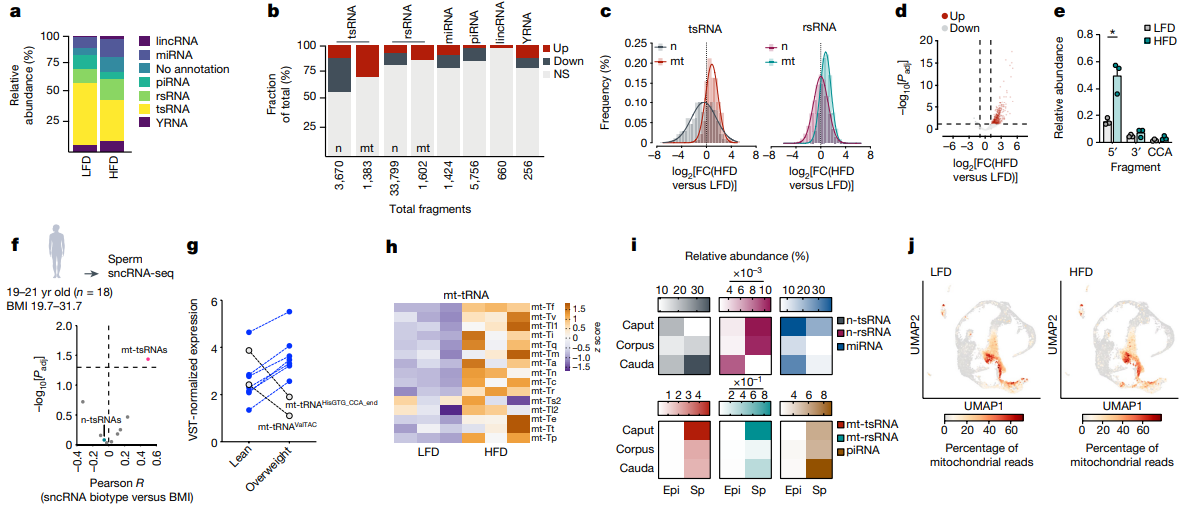
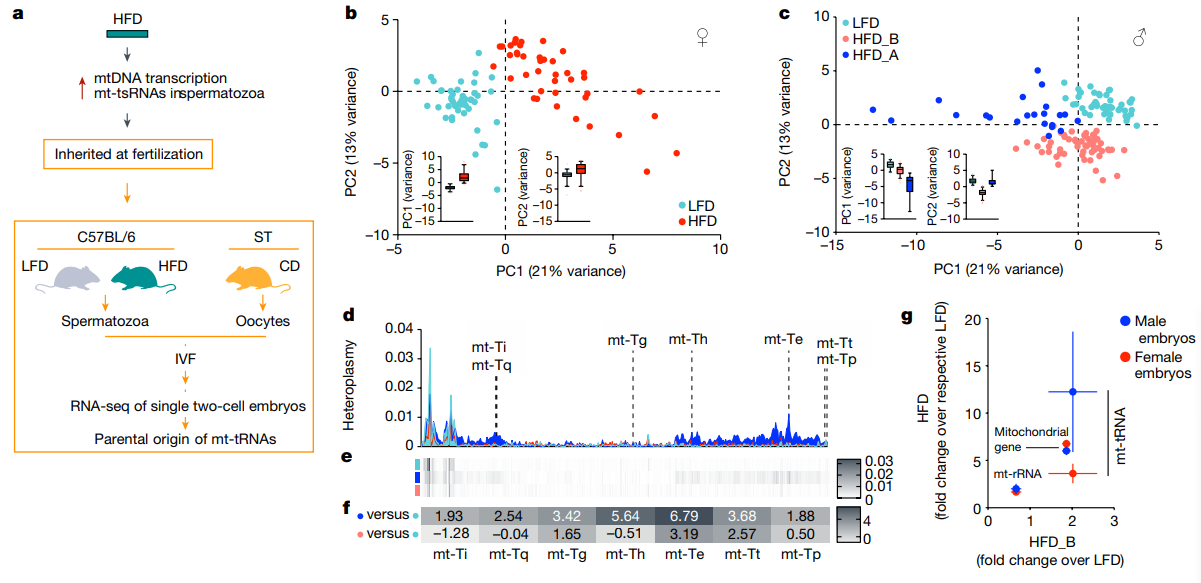
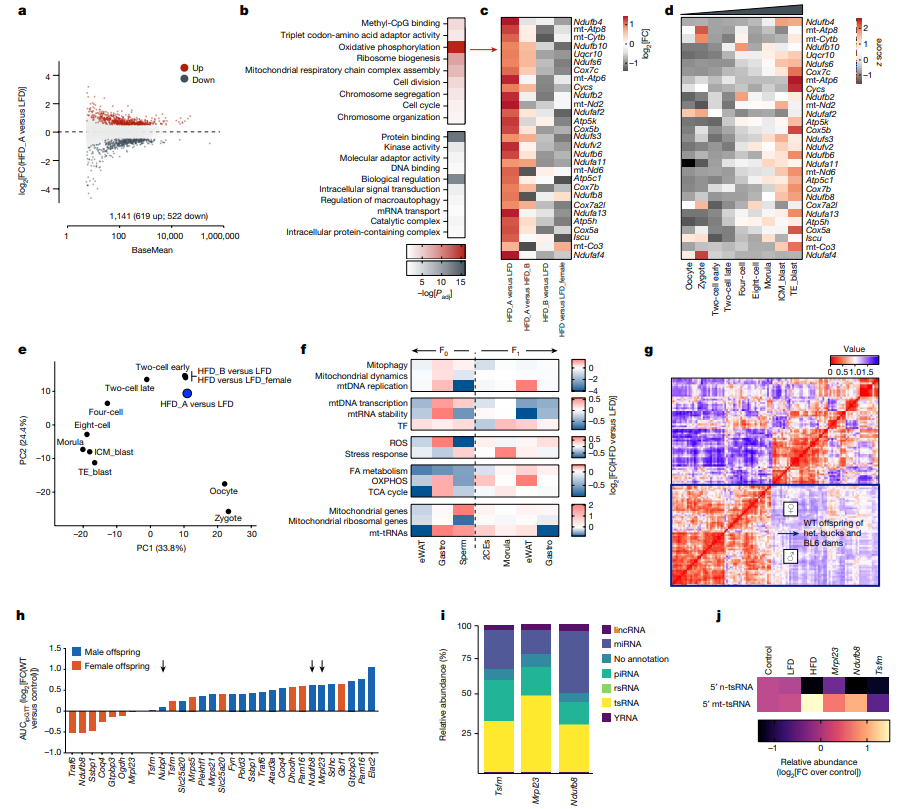
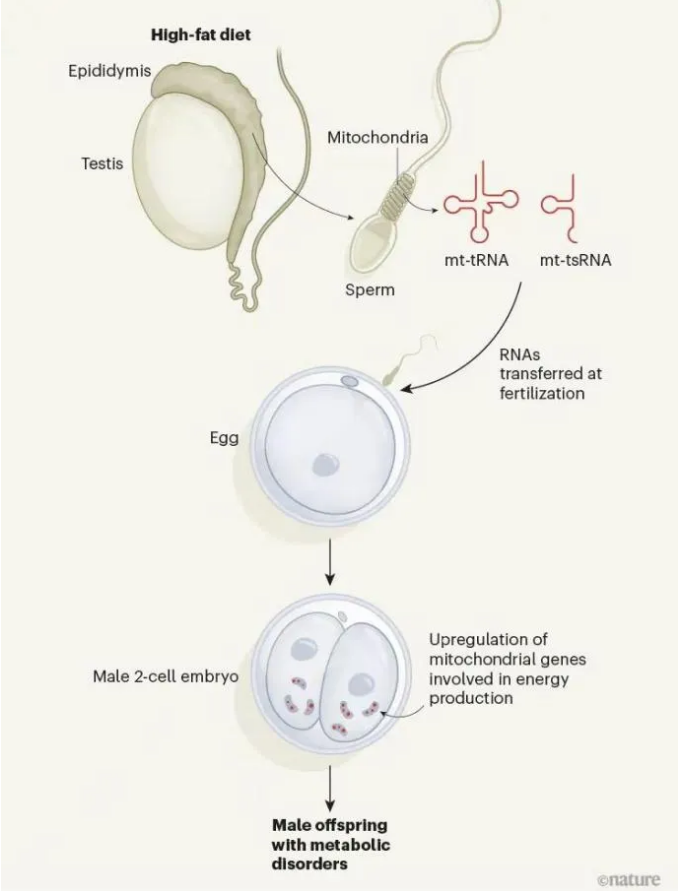
研究内容 1.附睾精子易受高脂饮食影响 考虑到小鼠精子发生过程在生精小管中大约历时35天,并在附睾中成熟(大约7天)。为了充分解析环境因素对于附睾精子的影响并有效区分不同时期暴露对于父源代际遗传效应的贡献,研究人员对6周龄雄鼠进行了2周高脂饮食(HFD)或低脂饮食(LFD)暴露,并在2周后使其与年龄匹配的未暴露雌鼠交配产生F1代(eHFD,附睾HFD暴露),或交配使附睾精子排空再予以4周的正常饮食喂养,使高脂饮食暴露的生殖细胞完成分化与成熟,再次交配获得F1代(sHFD,生精过程HFD暴露)(图1a)。精子发生过程和男性生殖健康未受到HFD的明显影响(睾丸切片、生精小管直径、精子活动率、受孕率和囊胚形成率和睾丸和圆形精子转录组没有明显变化)。但2周的高脂饮食足以使雄鼠体重增加、脂肪沉积增加以及糖耐量降低,后续4周正常饮食后可以逆转这些改变。 eHFD子代体重和体成分没有明显变化,但30%的雄性子代出现糖耐量受损(根据是否出现糖耐量受损可将子代分为高脂饮食不耐受的HFDi和耐受的HFDt)(图1b)。且该表型可在不同队列、不同季节、不同饲养环境中稳定出现。且糖耐量受损表现持续存在(8w后重测仍在)同时伴有胰岛素抵抗(图1c,d)。而sHFD组没有上述表现(图1b)。在eHFD子代中,HFDt和HFDi的表型差异可以反应在代谢活跃组织(肌肉、肝脏)的转录组特征上(图1e,f)。与莱西比儿童队列(Leipzig Adipose Tissue Childhood Cohort)脂肪组织的全基因组关联研究数据相对照,约有30%的HFDi特征基因(即在肌肉和脂肪组织中皆差异表达的基因)也在人类脂肪细胞中表达,并且与儿童期肥胖有关(图1g),这些基因主要聚类于细胞线粒体功能、炎症及细胞可塑性通路上(图1g)。 2.父亲BMI影响子代健康 亲代肥胖尤其是母亲肥胖已被证明是是子代儿童期肥胖最为关键的风险因素。为了挖掘父源因素对于子代代谢的影响,研究人员分析了LIFE Child Study(n=3431;NCT02550236)的人类数据。 尽管母亲BMI与父亲BMI、子代的BMI都有很强的相关性。子代BMI仍与父亲BMI独立相关(图1h)。多元回归分析提示父亲BMI对子代BMI约有6.5%的影响。对于母亲较瘦的家庭,父亲超重和肥胖使得子代肥胖风险倍增(OR=2.26,6.44,respectively, both p value<10-4)。父亲BMI的增高和子代的胰岛素抵抗相关(图1i)。父母双方BMI对子代胰岛素敏感性具有独立且累积的影响,这种效应在校正相关性和多基因效应后仍然显著。 这些结果明确了父亲孕前体重管理对于子代代谢健康的重要性。本研究的eHFD小鼠造模结果提示附睾精子易受高脂饮食影响,但sHFD小鼠造模结果也提示这种基于饮食的改变很可能是可逆的。 图1. 在人和小鼠中,父亲超重对于子代代谢健康有着重要影响 3.线粒体编码的tRNA碎片(mt-tsRNAs)由精子产生 精子中的小非编码RNA(small non-coding RNAs, sncRNAs)可能对饮食习惯改变敏感,发生表观遗传的改变。研究人员对2周高脂饮食喂养以及恢复正常饮食雄鼠的圆形精子和附睾尾精子进行sncRNA测序。不同样本中的不同类型RNA丰度分布符合预期,tsRNAs和piwi-RNAs分别在精子和圆形精子中最为丰富(图2a)。对eHFD-F0雄鼠附睾尾精子的sncRNA-seq结果进行差异表达分析发现,约有25%的sncRNA对于短期HFD暴露十分敏感,尤其是核tRNA的表达显著降低、片段减少(图2b,c),其中包括已被报道和父亲肥胖的跨代遗传有关的5’片段。相反地,线粒体mt-tRNA的表达和5’片段显著增加(图2c-e),其中约30%的注释序列具有统计学意义(图2b,d)。同时,线粒体来源的mt-rRNAs片段也显著增加(图2c),20%的注释序列有统计学意义(图2b)。对高脂饮食喂养后恢复正常饮食的sHFD-F0雄鼠附睾尾精子的sncRNA-seq进行差异表达分析,发现不同类型的RNA丰度均未见明显变化。附睾尾精子sncRNA-seq与子代表型结果相结合(图1),共同指示了主要是附睾易受短期高脂饮食暴露的影响,并且精子sncRNA在这一过程中可能作为动态变化的分子信号存在。 短期高糖暴露能够使黑腹果蝇和人类精子的mt-tsRNAs急剧上升[18,19]。为了进一步研究mt-tsRNAs和BMI的关系,我们对18位年轻健康的芬兰志愿者(年龄19-21岁)的射精后精子进行了sncRNA-seq进行测序,进行了深度代谢表型分析并根据BMI和脂肪质量进行分层。大部分的RNA类型分布和tsRNA组层在个体和不同BMI分组中可比。因为BMI是连续型变量,我们利用连续型差异表达分析算法去挖掘和BMI显著线性相关的sncRNAs。核n-tsRNAs并无明显变化,而线粒体mt-tsRNAs是唯一与BMI正相关的RNA类型(图2f)。总计约有0.5%序列被比对到mt-tsRNAs,且是随着BMI连续变化而持续差异表达,总计为29个序列,聚类到9个碎片,其中7个上调,其中下调的2个片段也是高脂喂养2周后下调的序列(图2g)。而在上调序列中mt-tRNASer-及mt-tRNAThr-来源的碎片也被短期高糖暴露上调,并在过度肥胖的男性的精子中下调。尽管这是小样本人群队列的结果,但也使人更加确信了mt-sncRNAs具有响应人和小鼠代谢变化的重要功能。 精子中核编码的n-tRNAs主要是在附睾转运过程中从附睾外泌体或细胞质小滴中获得。相反地,线粒体编码的mt-tRNAs可以在精子中自发活跃转录,因为线粒体DNA的转录在成熟精子中尤为活跃。全长的线粒体mt-tRNA转录本能够在成熟精子的常规RNA-seq中被鉴定到,且在两周高脂饮食暴露后明显升高(图2h)。更进一步的,对已经发表附睾外泌体、附睾尾精子及胞浆小滴的sncRNA-seq结果进行重分析[20,21],研究人员发现mt-tsRNAs和mt-rsRNA几乎只在精子中出现(图2i),这恰恰证实了mt-tsRNAs的生殖细胞来源,而不是体细胞或混合来源。睾丸单细胞转录组测序结果提示mtDNA转录在精母细胞阶段就已停止(图2j),与先前报道的结果相一致,且高脂饮食喂养也不会改变这一点。而在圆形精子中无法检测到mt-sncRNAs,所以mt-sncRNAs不可能从精子发生过程中被传递到成熟精子,而是由成熟精子感知外界环境,尤其是饮食习惯改变,导致附睾微环境的改变,转录产生mt-sncRNAs成为代际遗传效应的介导因子。 图2.精子产生的mt-tsRNAs能够反映男性健康状况 4.mt-tRNAs的表观遗传 为了研究精子产生的mtRNAs是如何实现代际传递的,研究人员取eHFD-F0和LFD-F0的C57BL/6N附睾尾精子和C57BL/6N-mtST的卵子进行体外受精获得胚胎。ST和BL6 mtDNA存在416个单核苷酸多态性(SNPs)的不同,且表现在部分eHFD-F0雄鼠附睾尾精子的差异表达mt-tRNAs。研究人员对200个杂交的早期二细胞胚胎进行单胚胎转录组测序,利用SNPs的不同来追踪父源mtRNA的跨代遗传(图3a)。 依据核转录组表现进行主成分分析聚类无法将LFD或HFD的胚胎区分开来,但依据线粒体转录组表现却能够区分(图3b,c)。尽管HFD-F1雌性胚胎更倾向于聚成一类(图3b),但HFD- F1雄性胚胎则更倾向于聚成独立的两类(图3c),其中约30%的HFD雄性胚胎(HFD_A)显著过表达mt-tRNAs。为了探究父源mt-tRNAs的贡献,研究人员对416个SNPs的父源基因频率进行定量。雄性HFD_A胚胎与HFD_B和LFD胚胎相比展现出了更高的异质性(heteroplasmy),特别是在能够翻译成mt-tRNAs的SNP位点(图3d-g)。雌性HFD胚胎较LFD胚胎也表现出了更高的异质性,但mt-tRNAs的异质性要弱于HFD_A的雄性胚胎(图3g)。 需要注意的是,精子中其他RNA也可以通过父系遗传,这些发现只是说明在生理条件下,受精后mtRNA能够从精子向卵子转移。30%的雄性子代出现代谢表型可能与精子mt-tRNAs向约占30%的HFD_A雄性胚胎亚群传递的偏好性相关(图3g)。 图3.精子mt-tRNA能够在受精时向卵子传递 5.早期胚胎的转录组学分析 差异表达分析揭示了HFD_A雄性胚胎较LFD及HFD_B雄性胚胎存在显著的转录重编程(图4a),然而HFD_B雄性胚胎或雌性HFD胚胎与其对照的LFD胚胎没有明显变化。HFD_A雄性胚胎差异基因GO分析主要富集在细胞代谢相关通路,其中以氧化磷酸化最为显著(复合体I, GO: 0006119 Padj<10-16)(图4b,c)。哺乳动物着床前发育存在连续代谢适应的过程,因为着床前胚胎从输卵管向子宫转移,氧浓度逐渐下降,导致胚胎氧化磷酸化水平的明显升高(囊胚是卵裂期的6倍)(图4d)。着床前胚胎过早激活氧化磷酸化可导致胚胎超微结构改变、成年小鼠线粒体结构和功能改变及糖耐量异常的发生。父亲的饮食结构能够影响着床前胚胎发育和早期胚胎代谢过程,尽管HFD_A雄性胚胎没有明显的发育迟滞(图4e),但早期胚胎氧化代谢的过早激活很可能与父亲超重和mt-tRNAs代际传递有关。 6.线粒体功能障碍具有类似于高脂饮食的影响 氧化磷酸化对于细胞和机体的生理功能至关重要。已有报道,小鼠高脂饮食暴露影响代谢脑、外周组织和生殖细胞的代谢稳态和线粒体功能。细胞会通过上调mtDNA的表达来代偿线粒体功能失调,这在成熟精子中亦然发生,所以需要健康的线粒体保证正常的受精能力。 比较亲代及子代的组织转录组测序结果,研究人员发现一些重要的线粒体代谢基因(例如,脂肪酸代谢相关基因)在高脂饮食雄鼠附睾白色脂肪组织、腓肠肌、精子中一致降低(图4f)。而在肌肉和附睾尾精子中,这一表现和mtDNA的转录上调相偶联。然而相反地,在子一代早期胚胎和成体组织中,这些与线粒体代谢相关的基因一致上调,只有早期胚胎表现出了父源mt-tRNAs的升高(图4f右)。基于上述结果,研究人员认为附睾尾精子中mt-tRNAs及mt-tsRNAs的上调是对高脂饮食诱导的线粒体功能障碍的一种代偿。 为了验证这一假说,研究人员利用IMPC系统性表型数据库,提取线粒体结构和功能基因异常的基因型杂合亲代的野生型子代代谢参数。由于这些基因中大多纯合致死或不育,所以研究人员提取的数据集能够包含亲本信息。利用基于Pearson的共相关分析,发现线粒体功能异常父亲对野生型子代脂肪堆积和糖耐量异常的影响主要集中于雄性子代(图4g)。研究人员通过欧洲突变小鼠突变保种组织(European Mouse Mutant Archive, EMMA)获得了IMPC上子代具有代谢异常表型的转基因小鼠的冷冻精子,包括线粒体核糖体蛋白Mrpl23、线粒体呼吸链复合体I亚基Ndufb8、 线粒体TS翻译延伸因子Tsfm三个突变品系,其中Mrpl23、Ndufb8两个突变品系的子代出现代谢重编程,而Tsfm子代并无表型(图4h)。这三个突变系的冷冻精子sncRNA-seq展现出了符合假说的RNA丰度表现(图4i),其中Mrpl23、Ndufb8突变雄鼠的精子中5’mt-tsRNAs的显著增多(图4j),与Mrpl23、Ndufb8突变雄鼠子代表型一致。精子线粒体结构和功能基因异常的子代表型与父亲高脂饮食暴露表型一致,支持精子线粒体功能障碍介导父亲高脂饮食导致子代代谢重编程的假说。 图4.父系表观遗传与线粒体代谢的关系 总结与展望 本研究提示雄性小鼠短期高脂饮食暴露导致线粒体功能失调足以引起雄性子代葡萄糖稳态受损,这与成熟精子中线粒体mt-tRNAs的转录激活及碎片化密切相关,而这些mt-tRNA会在受精时被传递给卵子,导致早期二细胞胚胎转录改变,尤其是氧化磷酸化相关基因的过早激活,增加成年期出现的糖耐量异常风险。 尽管受精时卵母细胞会排除父源线粒体,但父亲仍可以通过传递来自线粒体的mt-tsRNAs来影响子代的代谢健康。缺乏合子注射mt-tsRNAs足以导致代谢表型的实验结果,其他sncRNAs及表观遗传因子也可能对所观察到的表型有所贡献。但精子产生的mt-tRNA,以其可测定的表达强度、动态及可逆的表达模式,使其具有成为筛查标志物的潜力,可用于监测孕前生活方式干预效果,避免代谢疾病通过父源表观遗传模式传递。 图片来源Nature评论[17] 原文链接: 小编:徐静慧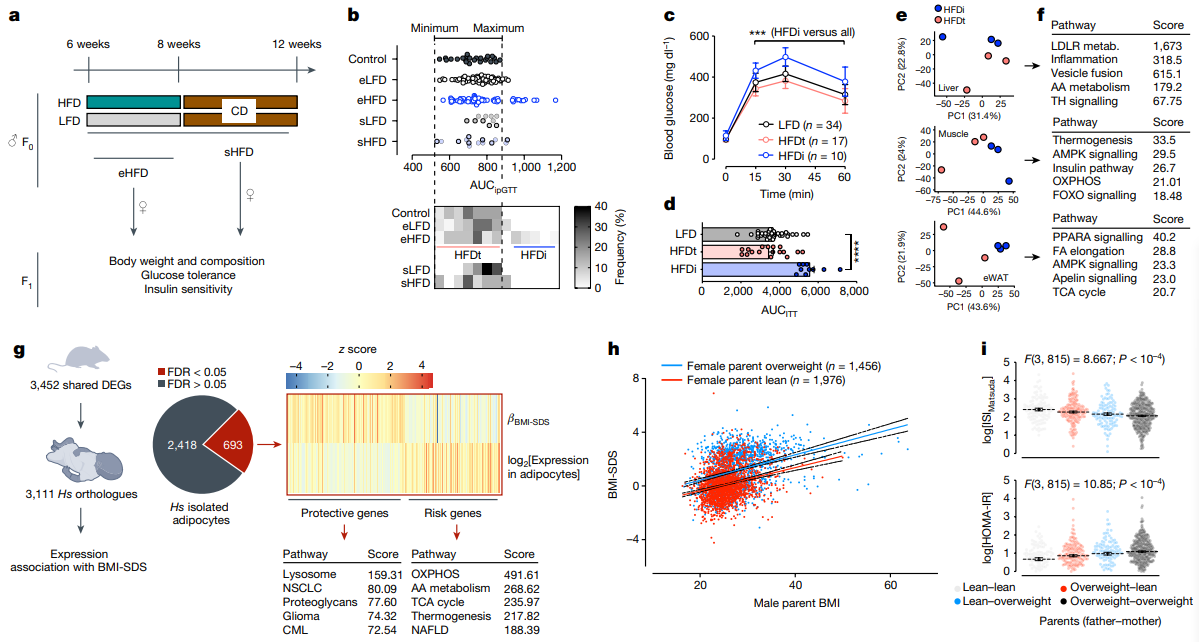
https://www.nature.com/articles/s41586-024-07472-3



