Nature aging|暴露于年轻卵泡微环境使老年卵母细胞恢复活力
暴露于年轻卵泡微环境使老年卵母细胞恢复活力 01 文献导读
生殖衰老是生育能力下降的主要原因,生殖衰老主要由卵母细胞数量减少引起,但其中的具体机制仍不清楚。2024年9月9日,新加坡国立大学的高级研究员汪海洋博士及其团队在Nature Aging杂志上发表了文章"Rejuvenation of aged oocyte through exposure to young follicular microenvironment"。该团队通过创造嵌合卵泡,将卵母细胞移植到另一个卵泡中培养,发现在老年卵泡中培养的年轻卵母细胞表现出受阻的减数分裂过程和发育潜力,而在年轻卵泡中培养的老年卵母细胞体外受精和胚胎植入后的成熟率、囊胚形成和活产率显著提高。这些发现为基于卵泡的体细胞疗法来治疗女性不孕症提供了基础。
02 研究背景 生殖衰老与卵子数量和质量的急剧下降有关1,2。35岁以后,卵母细胞成熟过程中极易因染色体错误分离而产生非整倍体卵子,导致孕妇流产或分娩的风险增加3。卵母细胞是高度分化的细胞,在胎儿发育过程中卵巢中卵母细胞数量有限。卵母细胞在进入生长和成熟前会休眠数月至数年,这是许多哺乳动物的常见现象。尽管全球生育率急剧下降,临床上仍没有可行的方法来提高老年卵母细胞的生殖能力。目前的方法如体外移植,卵巢内注射富含血小板的血浆,卵母细胞冷冻保存和卵巢组织移植等,主要解决卵巢储备不足和卵子数量下降的问题。此外,尽管一些研究表明,线粒体替代疗法可能会改善卵母细胞质量,但由于伦理问题,难以推广治疗。 卵母细胞的发育能力是在卵泡中获得的,由卵母细胞包围的体细胞(包括颗粒细胞和卵泡膜细胞)组成。卵泡的生长过程包括原始卵泡、初级卵泡、次级卵泡和窦状卵泡,最终到达排卵前卵泡。在这些阶段,颗粒细胞与卵母细胞连接从而向卵母细胞提供许多必需的营养素和代谢前体。反过来,卵母细胞为颗粒细胞的形态发生和增殖提供重要的信号分子。通过这种细胞间信号交流及代谢因子的相互交换,卵母细胞获得发育能力,并在减数分裂后成熟4。然而,分离的颗粒细胞与卵母细胞的简单共培养不能重建自然的相互作用模式。本文作者通过开发三维(3D)重建嵌合卵泡(RCF)的方法来克服这一障碍,通过将卵母细胞植入已经去除天然卵母细胞的受体卵泡中来恢复老年卵母细胞的生殖能力。
03 研究内容 1.年龄对重建卵泡卵母细胞质量的影响 作者发现,与年轻卵泡培养体系相比较,在老年卵泡的培养体系中,反映增殖活性的 Ki-67阳性体细胞百分比显著性降低(图1a,b)。老年卵泡中的体细胞也具有较高水平的 γH2AX 和活性半胱天冬酶 -3/7阳性细胞(DNA 损伤和细胞凋亡的指标),这两者都是衰老的标志(图1c-f)。此外,与年轻的卵泡体细胞相比,老化的卵泡体细胞表现出线粒体膜电位(ΔΨ m)减少和活性氧类(ROS)水平增加(图1g-i)。作者观察到卵泡体细胞和卵母细胞之间的线粒体 ΔΨ m 或 ROS 水平呈正相关(图1h)。以上结果表明,卵泡体细胞存在年龄相关性异常改变。 图1: 卵泡体细胞存在年龄相关性异常改变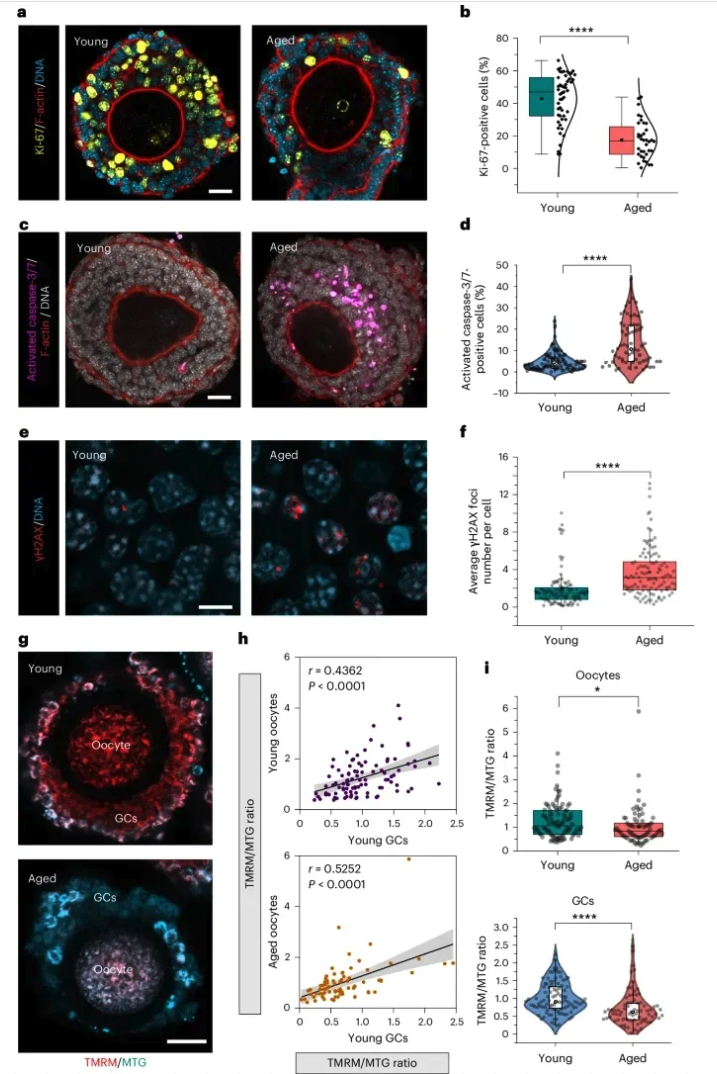
为了研究卵泡环境的老化如何影响卵母细胞的质量和能力,作者建立了一个基于卵泡生长和发育的三维离体培养系统。如图2a 所示,将来自小鼠卵巢的次级卵泡培养并包裹在海藻酸盐重建基底膜(rBM)互穿网络(Alg-rBM IPN)的水凝胶中,其能维持卵泡形态并使卵泡直径增加并达到窦状阶段(图2b)。作者证实,在卵泡培养物中生长的卵母细胞表现出大小、成熟率(第一极体挤出的频率)以及受精后发育成囊胚的能力与体内生长的卵母细胞相当。说明该三维体外卵泡培养系统在很大程度上模拟了体内条件,以支持卵母细胞的生长和发育。重要的是,该培养系统显示:来自老年小鼠(14-17个月)的卵泡比来自年轻小鼠(2-3个月)的卵泡生长更慢,并表现出更高水平的闭锁(图2c-e)。 为了探索卵泡体细胞老化是否损害卵母细胞的质量和发育能力,作者建立了 RCF (reconstituted chimeric follicles)培养的实验方案,将来源于次级卵泡的卵母细胞移植到另一个已被去除卵母细胞的次级卵泡中 (称为受体卵泡或 r- 卵泡)(图2f)。如图2g 所示,来自表达质膜靶向 tdTomato 的 mTmG 小鼠次级卵泡的供体卵母细胞, 被移植到来自野生型小鼠的 r- 卵泡中。结果显示,RCFs 在3D 培养系统中能从继发到窦期正常发育,并且这些 RCFs 内的卵母细胞成熟类似于体外培养的完整卵泡。为了评估卵泡体细胞老化是否影响卵母细胞质量,作者将年轻的卵母细胞移植到老化的 r-卵泡(所得到的 RCF 被命名为 YA,图2f)或年轻的 r-卵泡作为对照。在老年 r-卵泡中培养显著降低了年轻卵母细胞的减数分裂及成熟能力(图2h)。三维共聚焦成像显示,与 (未经 RCF 影响)年轻卵泡(Y)的卵母细胞相比,来自 YA RCF 的卵母细胞中异常减数分裂纺锤体和/或错位染色体的发生率增加(图2i-k)。此外,在体外人工受精(IVF)后,来自 YA RCF 的卵母细胞表现出减少的囊胚形成频率改成囊胚形成率(图21) ,表明暴露于老年卵泡环境的年轻卵母细胞的发育潜力受损。另外,RCF 和 Y 卵母细胞之间的测量结果没有显著差异(图2h-l) ,表明 RCF 程序本身不会损害卵母细胞质量。 图2: 老年卵泡环境影响年轻卵母细胞的质量和发育能力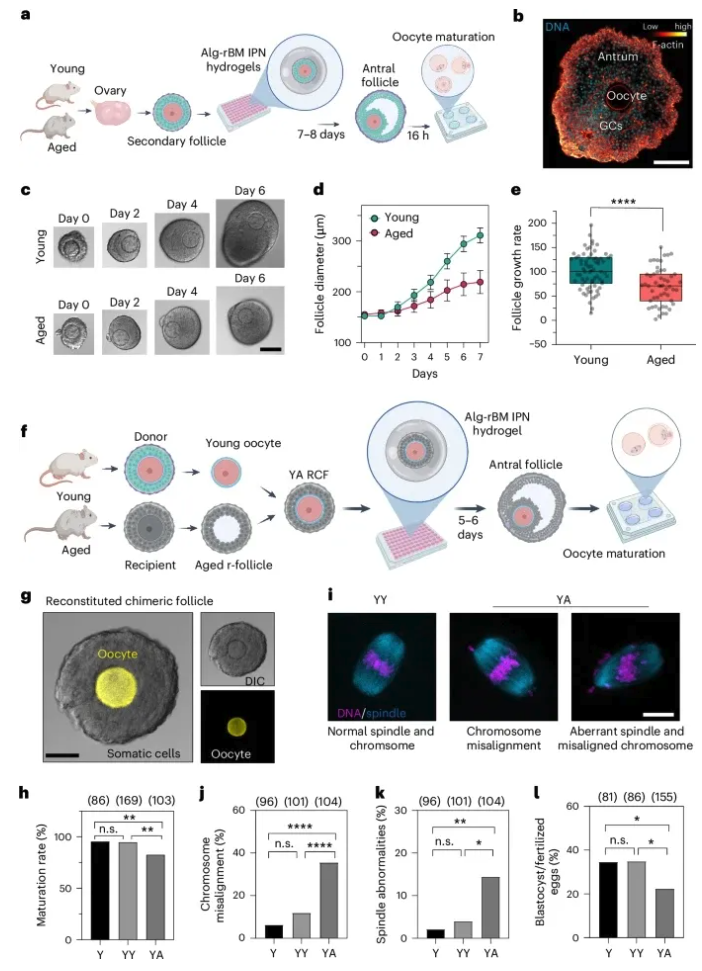
2.年轻卵泡环境对老龄卵母细胞成熟和发育能力的影响 作者进一步研究了年轻卵泡环境对老龄卵母细胞的影响(图3a),通过将老龄卵母细胞移植到年轻的r-卵泡(AY)。作者发现,在年轻 r-卵泡中培养,使老龄卵母细胞的减数分裂恢复到与年轻卵母细胞相似的程度(图3b)。体外受精后评估年轻卵泡环境中生长和成熟的老龄卵母细胞的胚胎发育潜力(图3c,d)。AY RCFs 显著提高了老龄卵母细胞的囊胚形成率(图3c,d)。AY RCFs 发育的囊胚的大小和总细胞数目也显著增加(图3e)。OCT4 + 细胞数量的增加(图3f,g)是妊娠成功的关键预测因子,作者通过将双细胞胚胎移植到假孕雌性体内,进一步验证了不同受精卵卵母细胞的发育能力 (图3h-k) 。这些结果表明,年轻卵泡环境可以部分恢复老龄卵母细胞的质量和发育能力。 图3: 年轻 r- 卵泡恢复老年卵母细胞的发育潜能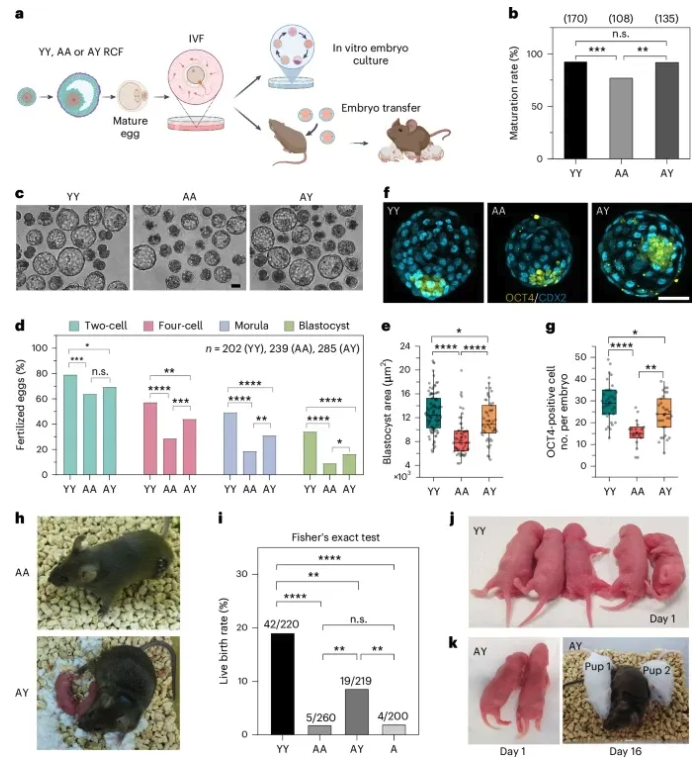
3. AY RCFs 与 AA RCFs 中 TZP (transzonal projections)形成的比较 通常,TZPs是颗粒细胞(GC)-卵母细胞相互作用的关键介质,TZP 的数量在卵泡老化过程中减少,作者接下来探索了 AY RCFs 中卵母细胞质量改善与 TZP 形成改善的可能性。为了观察 RCF 内的 TZP 重建过程,作者将野生型(非荧光标记的)卵母细胞移植到来自 mTmG 转基因小鼠的 r- 卵泡中 (图4a)。超分辨率显微镜成像显示存在类似于 TZP 的 tdTomato 标记的过程,从 GC 延伸到非荧光卵母细胞,在尖端具有特征性的球状肿胀(图4b)。免疫荧光染色显示,在与卵母细胞接触的tdTomato 标记端存在 N- 钙粘蛋白(图4c,d)。作者通过将未标记的野生型卵母细胞移植到与 Calcein AM (一种间隙连接通透性荧光染料)预孵育的 r- 卵泡中,用以检查卵母细胞和 GC 之间的间隙连接通讯(图4e)。共培养后在卵母细胞中检测到钙黄绿素 AM 荧光,当 RCF 与间隙连接活性的药理学抑制剂卡苯氧酮(CBX)孵育时,该染料转移被抑制(图4f,g)。这些结果表明,RCFs 内的 GC 可以延伸功能性 TZP 到达卵母细胞表面,重建卵母细胞与周围体细胞之间的通讯。作者发现 YA 卵母细胞周边每单位长度的 TZP 含量较低,表明老龄 GC 产生 TZP 的能力较低,AY RCFs 与 AA RCFs 或老化完整卵泡(A)相比显示出更高的 TZP 密度(图4h,i)。与 AA 和 A 相比,AY RCFs 中 TZP 形成的改善可能使年轻 GCs 更好地支持老年卵母细胞的生长发育。 图4. TZP 在 RCF 中的再生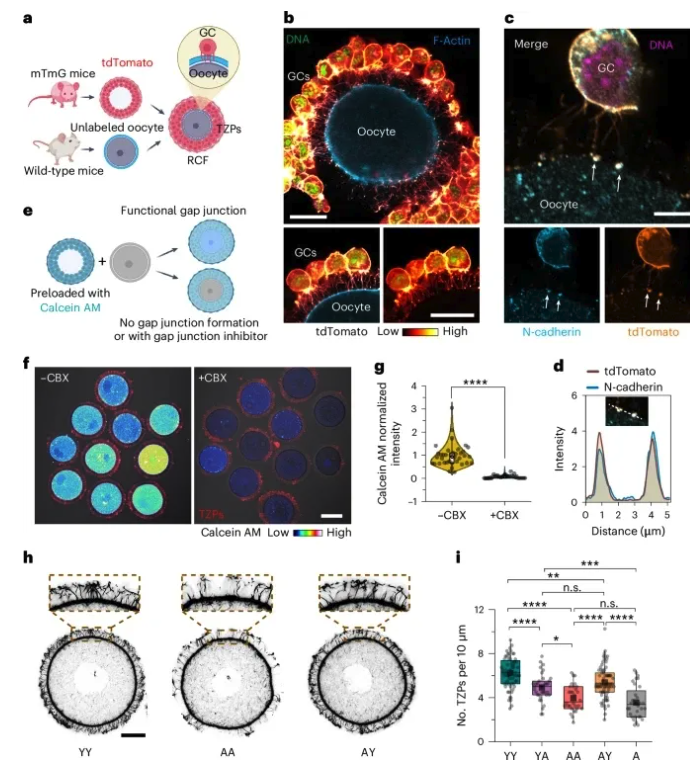
4. RCF 中卵母细胞的转录组学和代谢重构 为了研究年轻的卵泡环境是否可以改变老年卵母细胞的转录组学特征,作者接下来对多种卵母细胞进行了单卵母细胞 RNA 测序。数据显示 AY RCF 的老龄卵母细胞的转录组信息与RCF 的年轻卵母细胞更接近(图5a-c)。老龄卵母细胞在年轻的 RCF 中培养之后,其中大量与年龄相关的基因表达发生逆转(图5b,c)。基因组富集分析显示, AY RCF恢复了老龄卵母细胞中多个与卵母细胞发育相关的通路(图5d) ,包括雌激素信号传导,Ras 信号传导和核苷酸切除修复通路等5。通过基于液相色谱-串联质谱法(LC-MS/MS)的代谢组学分析,作者鉴定了136种代谢物,偏最小二乘判别分析(PLS-DA)显示 AY RCFs 的卵母细胞的代谢特征与 AA RCFs 的卵母细胞的代谢特征部分分离,表明年轻的 r-卵泡对老龄卵母细胞的代谢进行了重塑(图5e)。AA 卵母细胞的17种不同代谢物中,AY 卵母细胞的13种代谢物则与年轻卵母细胞的代谢物水平相似(图5f)。 图5. 年轻 r 卵泡培养老龄卵母细胞的转录组学和代谢组学重构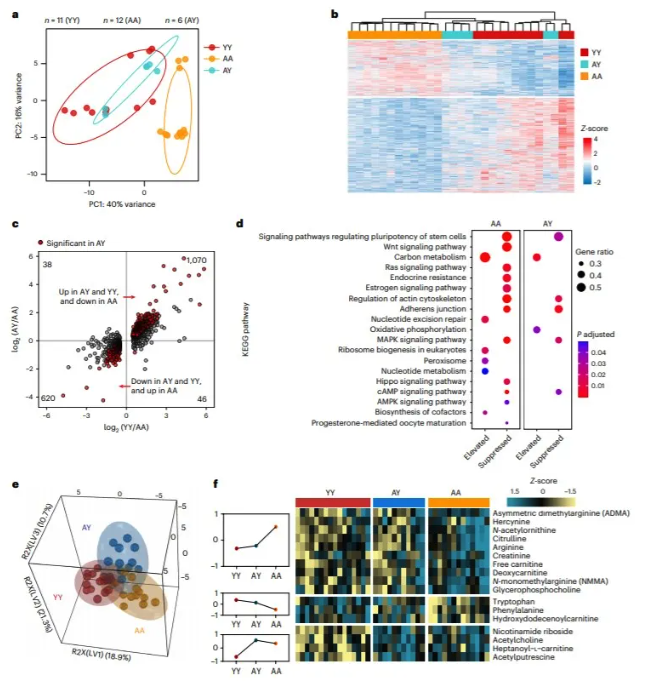
5. 年轻卵泡环境对老年卵母细胞线粒体功能的影响 由于代谢组学和转录组学分析揭示了 AY RCF 卵母细胞的代谢和生理学的潜在变化,因此作者进一步研究了线粒体功能和适应性,这对卵母细胞生长,成熟和发育潜力至关重要。作者观察到在 AA RCFs老化卵母细胞中有较低的 ATP 产生,但在 AY RCFs 的卵母细胞中, ATP 产生则大量恢复(图6a)。用 MitoTracker 染色的卵母细胞共聚焦显微镜显示,来自 AA RCF 的卵母细胞中的线粒体表现出异质的聚集分布,这表明卵母细胞的质量随着年龄增加而下降。来自 AY RCF 的卵母细胞的线粒体比来自 AA RCF 的线粒体表现出更均匀的细胞质分布,与年轻卵母细胞中观察到的分布非常相似(图6b,c)。年轻 r-卵泡内培养则恢复了老年卵母细胞线粒体膜电位(图6d-f)。AY RCFs 的卵母细胞比 AA RCFs 老化卵母细胞表现出更低的线粒体和细胞 ROS (图6g-j)。 图6. 在年轻卵泡中培养的老化卵母细胞中恢复的线粒体活性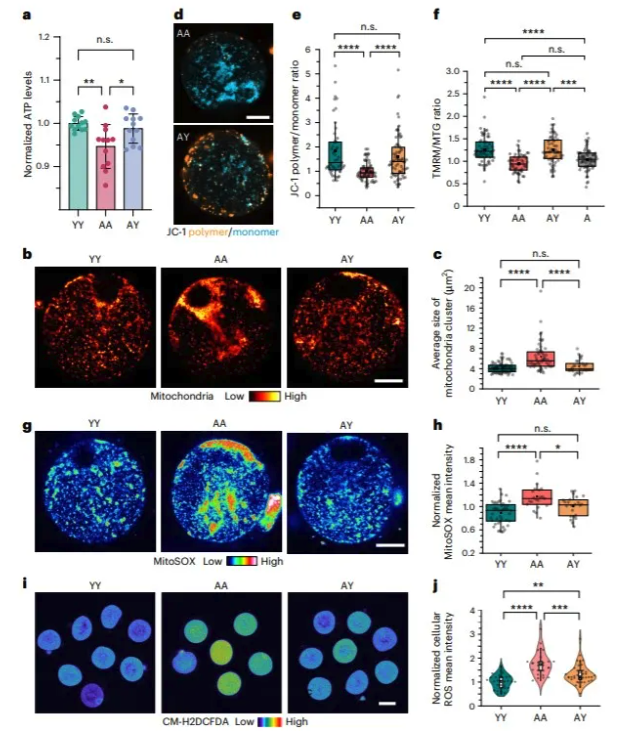
6. AY RCFs 减数分裂染色体分离的改善 为了评估染色体数目,作者对注射了编码 mCherry-taggedhistone H2B (H2B-mCherry)和两个串联 mEGFP 标记的 CENP-C (2mEGFP-CENP-C) mRNA 的信使 RNA MII 卵母细胞进行超分辨率成像,以分别标记染色体和动粒。三维重建能够准确地显示和定量卵母细胞中的染色体和动粒数目(图7a)。作者量化了“染色体异常”,其中包括姐妹动粒(非整倍体)数量的改变和姐妹染色单体(PSSC)的过早分离(图7a,b)。来自 AA RCF 的老年卵母细胞中观察到更高频率的非整倍体和 PSSC(premature separation of sister chromatids), 尽管无统计学意义,AY RCFs 的卵母细胞显示出非整倍体率显著降低和 PSSC 率降低 (图7b)。卵母细胞中与年龄相关的非整倍体归因于减数分裂前粘附素的过早丧失,作者对一种减数分裂粘连成分 Rec8进行了免疫荧光染色,并测量了它在染色体上的信号强度(图7c)。结果显示,来自 AA RCF 的年龄卵母细胞中的染色体 Rec8水平显著降低,AY 受体卵母细胞中的染色体 Rec8水平显著高于 AA 受体卵母细胞 (图7c,d)。来自 AY 的卵母细胞在姊妹动粒之间的距离比来自 AA RCF 的卵母细胞更短(图7e-g) ,表明年轻的卵泡微环境有助于维持老年卵母细胞中的中心凝聚。非整倍体的另一个原因是纺锤体异常和后期染色体滞后。为了监测染色体分离,作者发现,在减数分裂后期,AY RCFs 卵母细胞中滞后染色体的发生率显著低于 AA RCFs (图8b)。来自 AA RCF 的卵母细胞含有出错误的动粒-微管(KT-MT)附着(未附着,merotelic 和侧向附着)(图8c-f)。年轻 r-卵泡培养的老龄卵母细胞中不正确的 KT-MT 附着的发生率显著降低(图8e)。总之,这些数据表明,年轻的卵泡微环境通过更好地维持染色体粘附,和减少染色体分离,改善了减数分裂染色体在卵母细胞中的传递。 图7.年轻卵泡环境中培养的老年卵母细胞染色体异常和粘连蛋白丢失降低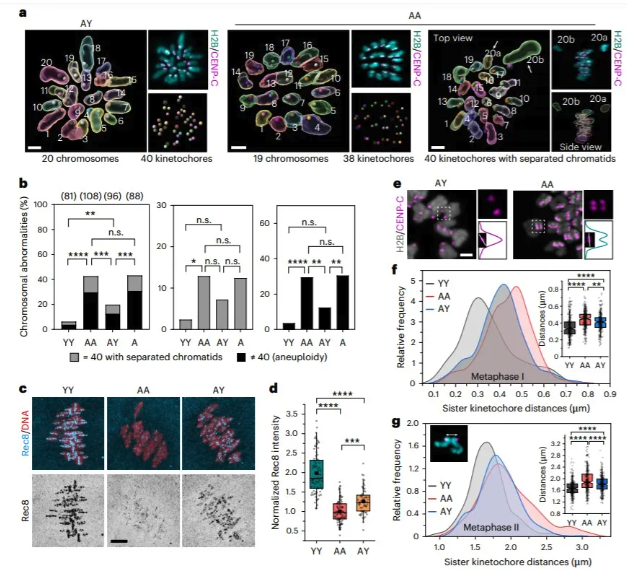
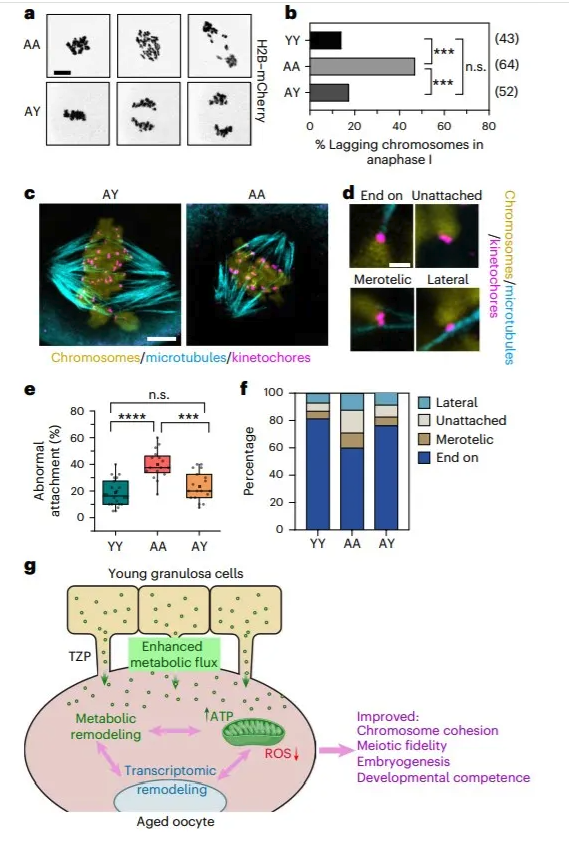
图8. 年轻卵泡体细胞提高年老卵母细胞染色体分离保真度
04 总结及展望 作者利用小鼠卵泡作为模型,通过构建嵌合卵泡,验证了老化的卵泡环境可以使有较好发育潜力的年轻卵母细胞质量和发育受损。而且,该研究阐释了年轻的卵泡环境可以恢复老龄卵母细胞质量,提高随后的胚胎发育和活产率。该研究表明年龄相关的卵母细胞质量下降可被年轻健康的卵泡微环境逆转。这为基于高龄生育困难的细胞治疗方法提供了研究方向。本研究开发的 RCF 培养系统也为探索年龄相关变化的机制提供了一个有参考价值的研究模型。 小编:郑秋彤 原文链接: https://www.nature.com/articles/s43587-024-00697-x




