Nature| 衰老小鼠卵巢的单细胞图谱
衰老小鼠卵巢的单细胞图谱 01 文献导读
卵巢衰老、卵泡不断消耗、卵泡质量下降会导致女性生育力出现急剧下降,且这一趋势不可逆转[1]。据报道,女性在35-40岁生育力就会随着卵母质量下降而出现显著性下降[1],但目前关于卵巢衰老的早期驱动因素仍不甚清晰,缺乏衰老小鼠卵巢基因组变化的全面细胞图谱。
2024年1月10日,来自俄克拉荷马退伍军人医疗中心Michael stout团队在Nature aging上发表了题为“A single-cell atlas of the aging mouse ovary”的文章。该研究发现衰老小鼠卵巢内免疫细胞比例增加,卵泡细胞中应激反应、免疫反应和纤维化信号通路上调,为卵巢衰老领域提供了细致全面的单细胞图谱。
02 研究背景 随着大部分女性选择推迟生育计划的社会现象日益突出,全球不孕人群、不良孕产史人群逐年增长[1]。卵巢衰老不仅导致生育能力下降,还会引起女性内分泌信号失调和慢性疾病发病率增加[2,3]。因此,深入了解卵巢衰老的机制对于延长女性生育能力和减少与年龄相关慢性疾病的发生至关重要。 研究表明,年龄相关的卵巢功能衰竭与DNA损伤、线粒体功能障碍、活性氧产生增加、炎症反应和组织纤维化有关[4],但首先产生这些影响局部微环境变化的应该是哪类细胞,以及卵泡细胞、基质细胞或两者在促进卵泡衰竭和卵巢衰竭中所起的作用也不甚清晰。卵巢衰老领域亟需衰老小鼠卵巢转录组变化的全面细胞图谱,以确定卵巢衰退的早期驱动因素,开发延长女性生殖寿命的干预方法。 03 研究内容 1.小鼠卵巢单细胞测序鉴定出15类细胞 小鼠3月龄到9月龄期间是卵泡储备下降最严重的时期,研究者收集了3月龄和9月龄雌性小鼠的卵巢(C57BL/6 J),每组4只。在对卵巢组织全细胞进行单细胞测序UMAP降维后,研究者共鉴定出15类细胞,其中3类基质细胞,1类卵泡膜细胞,2类巨噬细胞,1类内皮细胞,1类T淋巴细胞,2类上皮细胞,1类卵母细胞,1类黄体细胞,1类B淋巴细胞(图1a),15类细胞各自有不同基因标记(图1b)。 图1. 小鼠卵巢的单细胞测序结果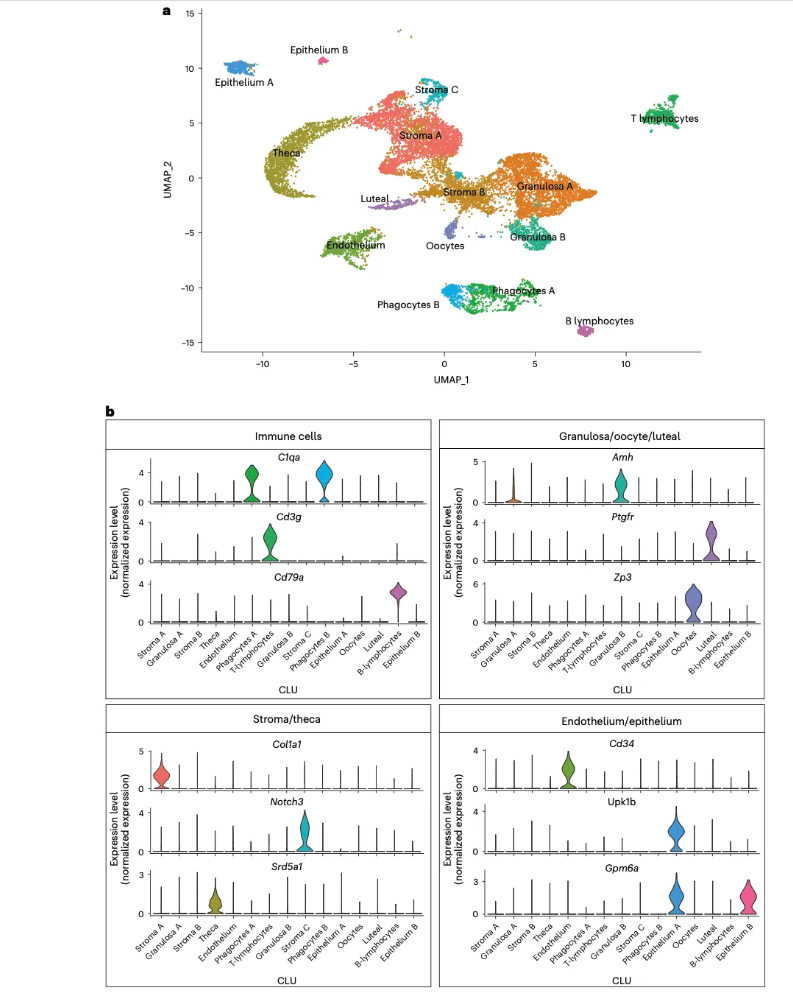
2.卵巢各类细胞比例发生年龄相关性改变 研究者发现年龄增长导致小鼠卵巢细胞比例发生改变。9月龄小鼠卵巢中颗粒细胞比例显著降低,免疫细胞比例显著增加(图2a、b),原始和三级卵泡数量明显下降,二级卵泡数量有下降趋势(图2c-e)。 图2. 卵巢各细胞比例发生年龄相关性改变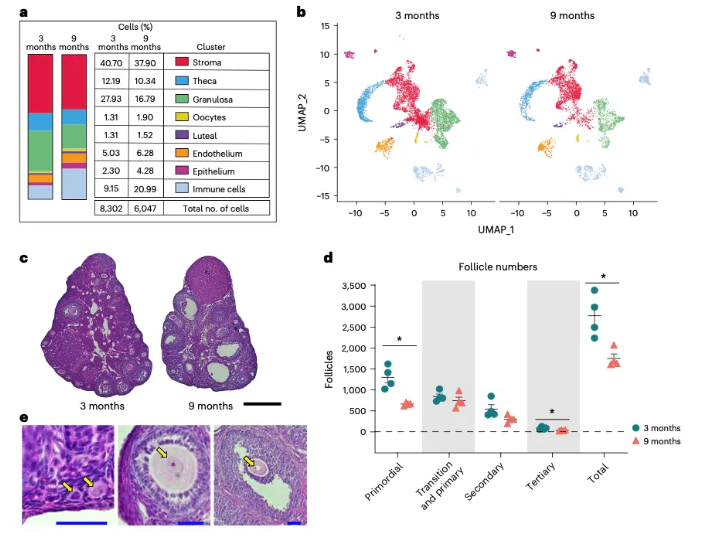
3.淋巴细胞累积在衰老小鼠卵巢中 进一步分析发现,免疫细胞共4类,13亚类,各自有不同标记 (图3a-c)。随着年龄增长,增加最多的免疫细胞是淋巴细胞,包括B细胞、1型/17型淋巴样细胞和CD4+T细胞。巨噬细胞和单核细胞在老年卵巢中比例呈增加趋势,但未达到统计学意义(图3d)。CD300e+单核细胞仅存在于9月龄小鼠卵巢中(图3d)。CD300e+单核细胞负责调控T细胞活化,可能是应对T细胞积累的一种代偿机制,也可能是由于灌注不足导致的单核细胞趋化,有待进一步研究。经过流式细胞术验证,与单细胞测序结果相同的是,9月龄小鼠卵巢中CD90+细胞(T细胞和先天淋巴样细胞)的比例和数量显著增加(图3e,f),但B细胞和髓细胞并没有变化(图3e,f),这与单细胞测序结果不一致。 图3. 淋巴细胞累积在衰老卵巢中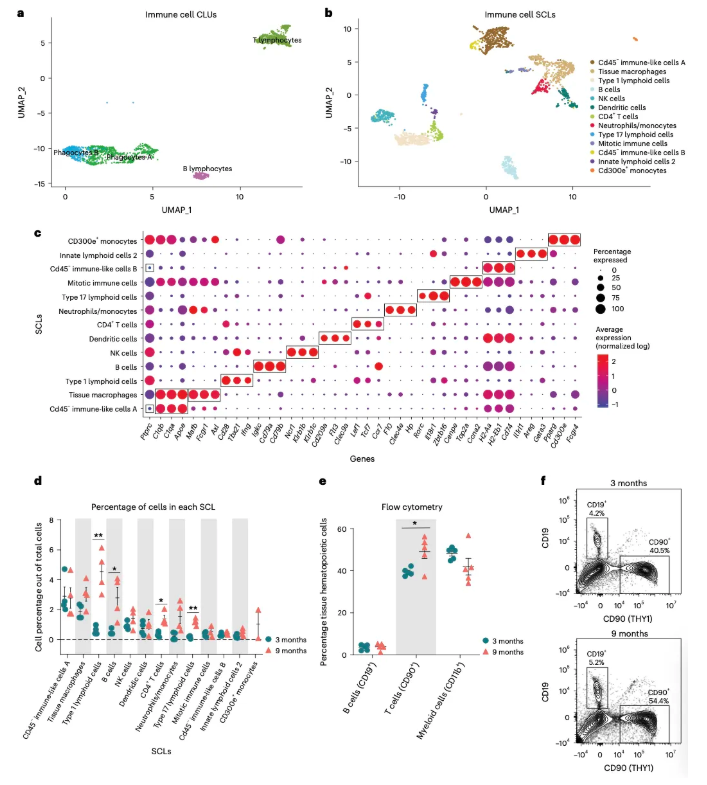
4.淋巴细胞在衰老小鼠卵巢中增减不一 研究者进一步对流式细胞术数据进行了UMAP分析 (图4a),在CD90+细胞中, CD8+ T细胞、双阴T细胞(DNs)、MALT细胞、NKT细胞和γδT细胞的显著增加;CD4+ T细胞和先天淋巴样细胞显著减少(图4b)。为比较单细胞测序和流式细胞术的结果,通过分析效应转录因子,研究者对1型(RORγT)、17型(T-BET)淋巴样细胞中的CD90+细胞进行分析,结果发现,单细胞测序结果中1型淋巴样细胞的增加是1型NKT细胞显著增加所致,而1型DN和γδT的比例是下降的,17型淋巴样细胞所有亚群都随着年龄的增长而增加(图4c,d)。此外,流式细胞术发现了单细胞测序结果中未捕获的1型先天淋巴样细胞,且1型先天淋巴样细胞比例随着年龄的增长而下降(图4e,f)。 图4. 衰老卵巢淋巴细胞数目发生改变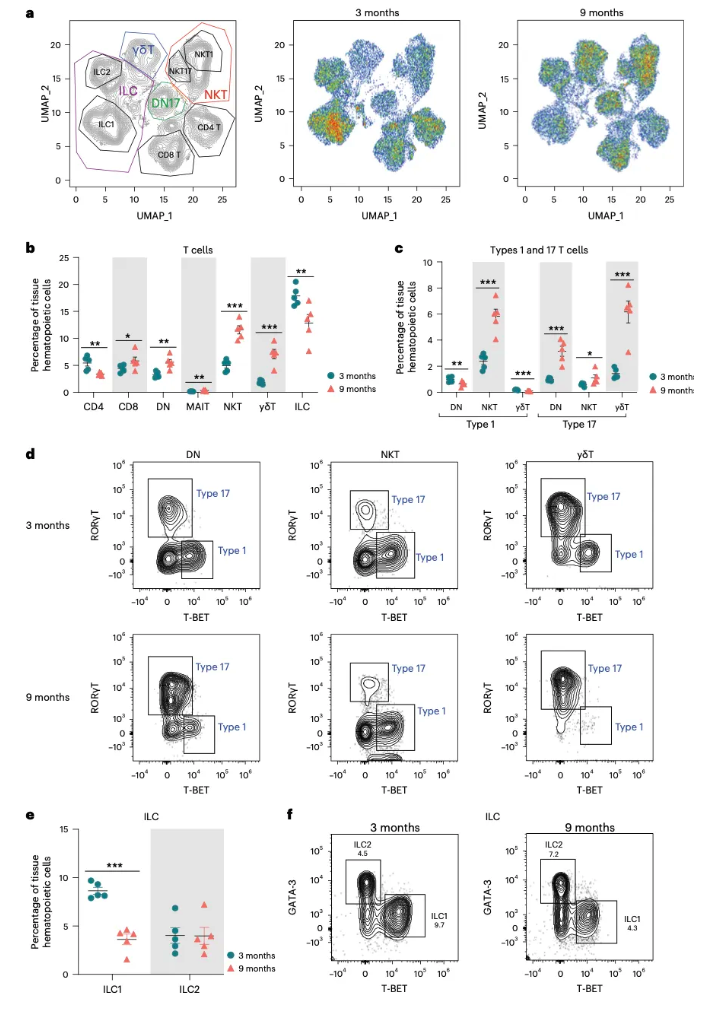
5.衰老小鼠卵巢基质细胞和卵泡膜细胞中信号通路发生变化 随着卵巢衰老,卵巢基质细胞和卵泡膜细胞也发生了相应的变化。UMAP结果显示基质细胞和卵泡膜细胞共6类,各自有不同标记(图5a-c)。IPA分析(信号通路分析)结果显示,9月龄小鼠卵巢中,成纤维样细胞内组织重塑和纤维化相关通路表达上调,雌激素和促性腺激素释放激素信号通路表达下调(图5d)。 图5. 基质细胞和卵泡膜细胞的亚聚类分析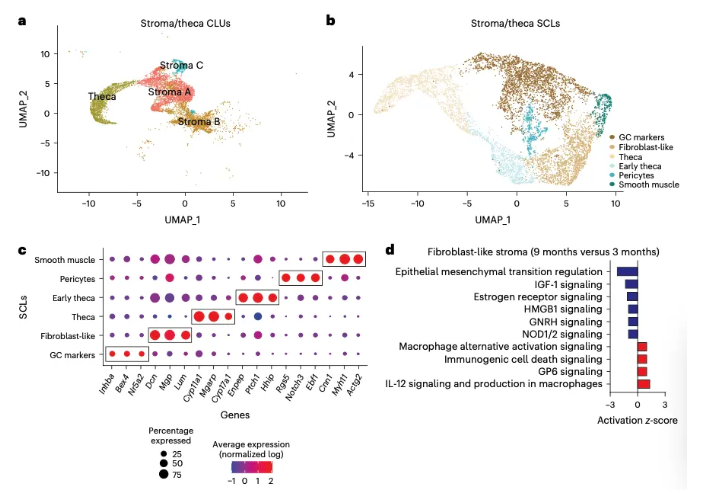
6.基质细胞和卵泡膜细胞中信号通路改变导致卵巢组织重塑和纤维化 因IPA分析显示9月龄小鼠卵巢成纤维样细胞中组织重塑通路上调,研究者针对胶原基因表达进行了相关分析,结果显示卵巢成纤维样细胞胶原基因表达随着年龄的增加而上升(图6a),卵巢组织PSR染色显示9月龄小鼠卵巢组织胶原沉积增加(图6b),成纤维样细胞中胶原酶途径下调(图6c)。在卵泡膜细胞内,与炎症反应和纤维化相关的几个上游调控因子显著上调(TGFB1、TGFB2和SMAD3;图6c),这表明卵泡膜细胞可能是最早参与胶原生成和沉积的细胞类型之一。 研究者进一步发现,随着年龄增长,成纤维样细胞中基质金属蛋白酶2基因表达下降(MMP,一种参与胶原降解的关键酶) (图6d),卵巢间质MMP2蛋白沉积减少(图6e)。胶原酶减少,胶原蛋白降解减少,导致卵巢组织胶原蛋白沉积。除此之外,成纤维样细胞中与炎症反应和纤维化相关的上游调控序列也出现显著下调(图6c),这可能是一种代偿反应:促进炎症和纤维化的信号可能来源于其他细胞,尤其卵巢内免疫细胞数量也显著增加。据报道,其他组织中(肺、肠道、肿瘤等)的成纤维细胞在慢性炎症的调节中发挥免疫抑制作用[5]。 TGF-β信号通路与调节淋巴细胞趋化、活化和存活有关, TGF-β信号随年龄增长表现出差异。卵泡膜细胞在卵泡内各细胞间的信号转导中起重要作用,研究发现3月龄小鼠卵巢中卵泡膜细胞会与多种细胞进行信号转导(图6g),但9月龄小鼠卵巢中的卵泡膜细胞仅和免疫细胞之间存在TGF-β信号(图6h),这可能与9月龄小鼠卵巢中淋巴细胞累积有关。此外,9月龄小鼠卵巢中的颗粒细胞B群新出现了TGF-β信号(图6g,h),卵泡膜细胞中关于炎症反应、细胞应激和增殖的信号通路上调(图6i),细胞增殖上游调控序列表达上调(MTOR、YAP1和RB1,图6j)。这些结果表明,随着年龄增长,卵巢基质细胞和免疫细胞间持续存在的纤维化信号可能对卵巢衰老产生了重要影响。 图6. 卵巢基质细胞和卵泡膜细胞信号通路发生改变后的生物学意义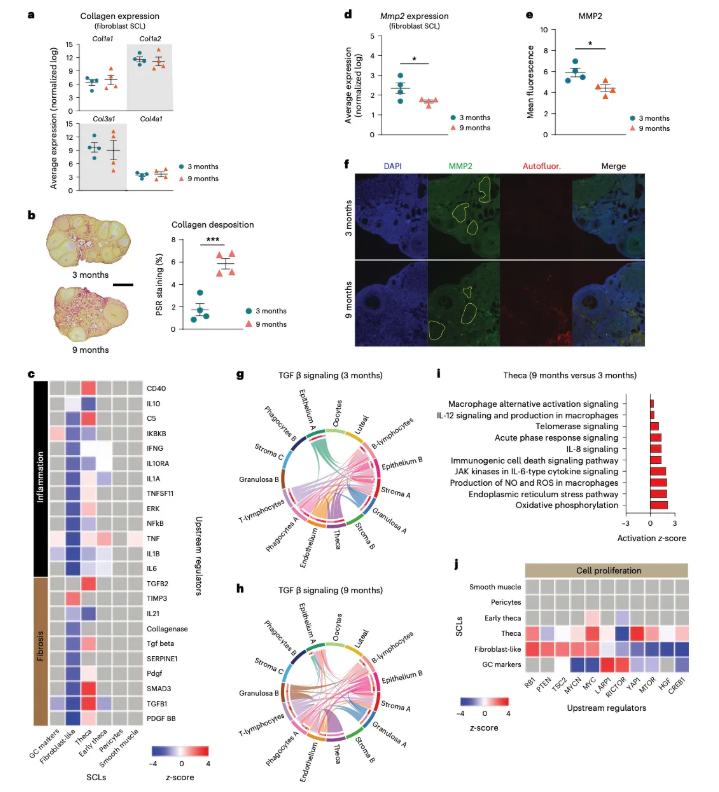
7.衰老小鼠卵巢中颗粒细胞和卵母细胞功能发生改变 UMAP结果显示颗粒细胞、卵母细胞和黄体细胞共6类(图7a-c),其中颗粒细胞4类,包括卵泡不同发育阶段的颗粒细胞,如窦前、窦性、有丝分裂和闭锁颗粒细胞。颗粒细胞与卵母细胞间存在信号交流,它能将雄激素转化为雌激素并释放到体循环中,作用于下丘脑发挥负反馈作用。 IPA分析显示随着年龄增长,窦前、窦性和闭锁GCs中与促炎应激和纤维化相关的通路上调(图7d-f),卵母细胞内线粒体功能障碍显著增加(图7g)。这些结果显示衰老加剧了炎症反应和纤维化的过程。 图7. 颗粒细胞、卵母细胞和黄体细胞的亚聚类分析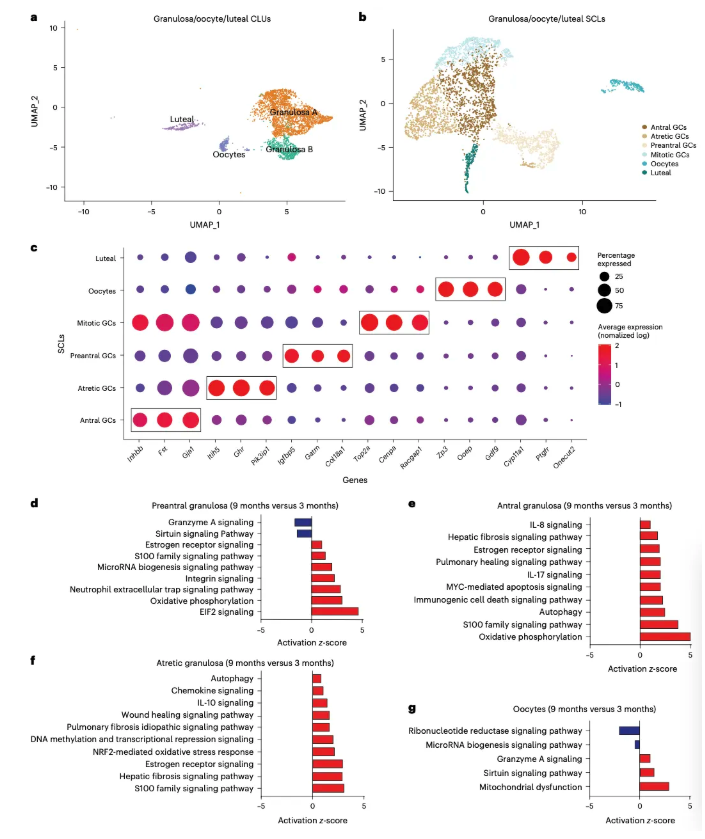
8.衰老对内皮细胞和上皮细胞的影响较小 UMAP结果显示内皮细胞和上皮细胞共4类(图a-c)。内皮细胞是血管和淋巴管的重要组成部分,卵巢组织内存在丰富的脉管网络,参与免疫细胞的运输。卵巢最外层是生发上皮,增殖活跃,参与卵巢组织排卵后修复,在卵巢周期中动态扩张和收缩。 IPA分析发现只有血管内皮细胞中的信号通路会随着年龄增长而发生变化,表现为DNA损伤调节通路上调(图8d),细胞衰老相关基因的上游调控元件激活(TP53、CDKN1A和CDKN2A) (图8e)。而细胞衰老基因激活(TP53、CDKN1A和CDKN2A)会引起各自下游基因激活(图8f)。卵巢组织血管重塑活跃,可能会加速内皮细胞衰老。虽然细胞衰老相关基因上游调控元件会随着年龄增长而激活,但这些基因本身的表达并没有显著增强(图8g)。综上所述,目前并无证据能够明确血管内皮细胞是否是率先衰老的细胞之一。 图8. 内皮细胞和上皮细胞的亚聚类分析
总之,研究者用单细胞测序技术分析了小鼠卵巢转录组的年龄相关变化,分析了不同月龄小鼠卵巢主要细胞类型,并进一步研究了各亚细胞簇发生的衰老相关的变化。该研究揭示9月龄小鼠卵巢内免疫细胞比例翻倍,以1型NKT和17型γδT细胞为著。随着年龄的增长,颗粒细胞、基质细胞和卵泡膜细胞内有关应激反应、免疫反应和纤维化的信号通路上调。卵巢基质胶原酶表达下调,导致胶原蛋白沉积。免疫细胞本身就表达细胞衰老相关基因,卵巢细胞衰老可能是免疫细胞累积的结果。 04 总结及展望 本研究为卵巢衰老领域提供了细致全面的单细胞图谱,也揭示了衰老卵巢发生慢性炎症反应和纤维化的潜在机制。先天T细胞是一种组织驻留细胞,其功能多样。它既能维持组织稳态,在抗感染、抗肿瘤等过程中充当前哨细胞,又在肝、肾、肺等器官的纤维化过程中起关键作用。然而,先天淋巴细胞在卵巢组织中发挥的作用还不是很清晰,仍需进一步研究。值得注意的是,多核巨细胞是卵巢衰老的标志,中性粒-单核细胞可通过吞噬作用衍变为多核巨细胞。本研究在样本准备阶段剔除了多核巨细胞,可能对结果造成了影响。此外,小鼠、非人类灵长类动物和人类间的排卵模式、相关生物学功能和信号通路表达不同,中老年小鼠并不能完全代表非人类灵长类动物和人类相应年龄段表现出的变化,因此还需要对其他模式动物进行更深入的研究。 小编:刘雅龙 原文链接: https://www.nature.com/articles/s43587-023-00552-5




