Nature Communications | 张丹课题组揭示卵母细胞铁死亡在卵巢功能不全发病中的作用及机制
我们常把卵巢比作生命的泉眼,宛如一湾清泉蕴含着原始的生命活力。一旦泉眼枯竭,便难以孕育新生命。原发性卵巢功能不全(Primary Ovarian Insufficiency,POI),就如同过早干涸的泉眼,它是一种临床综合征,主要表现为原始卵泡过早地被耗尽。POI 会引起不生育、严重扰乱日常生活和长期的健康风险。然而,潜在的机制仍然是未知的。
2022年10月,浙江大学医学院附属妇产科医院张丹教授团队在Nature子刊Nature Communications上发文:BNC1 deficiency-triggered ferroptosis through the NF2-YAP pathway induces primary ovarian insufficiency。文章中,作者通过建立Basonuclin 1 (BNC1)特异性敲除小鼠模型,观察到BNC1缺陷导致卵泡过早激活和过度闭锁,从机制上探索发现BNC1缺陷能够通过NF2-YAP途径触发卵母细胞发生铁死亡。最后使用药物抑制YAP信号传导或铁死亡能显著挽救BNC1突变引起的POI,为POI的临床诊治提供了理论基础。

研究背景
原发性卵巢功能不全(Primary Ovarian Insufficiency,POI)是指在40岁之前原始卵泡过早地被耗尽,具体表现为至少4个月的月经稀发或闭经,伴有促性腺激素增高(FSH水平>25 IU/L,间隔两周以上)[1-2]。POI对这些患者的日常生活造成严重的干扰,包括潮热、疼痛、出汗、睡眠障碍、阴道干涩和抑郁症等[3]。与POI有关的另一个主要问题是生育力的损害,甚至可导致育龄妇女不孕。POI的潜在病因可分为遗传性、自身免疫性或人为因素。虽然POI的直接原因在大多数情况下是未知的,但这种疾病通常是由原始卵泡的形成、卵泡的募集/分配、卵泡的生长和发育等方面的缺陷引起的[4-6]。
过去的研究主要集中在参与POI发病机制的基因上。作者从既往的一个大型中国人POI家系中确定了碱性核蛋白1(Basonuclin 1 ,BNC1) 基因中存在截短突变。截短突变是指由于DNA序列碱基的突变,使得终止密码子提前出现,导致蛋白序列翻译不完整,造成蛋白质功能缺失的突变类型。前期研究已经证实敲除BNC1后,小鼠会出现POI的表型,但是具体的机制仍然不清楚[7-8]。因此,在本研究中,作者深入机制研究,探讨BNC1敲除后是通过何种通路导致POI的发生,并且提出了潜在的挽救措施。
研究思路与结果
1. BNC1缺陷诱导卵泡过度活化和闭锁导致POI表型
为了确定BNC1缺陷对卵泡生成的影响,研究人员首先分别对4周和12周龄的BNC1tr/tr小鼠(纯合突变)和野生型(WT) BNC1+/+小鼠进行超促排卵,收集GV期的卵母细胞。分析小鼠在卵泡生成上的动态变化。结果发现,与WT小鼠相比,4周龄的突变小鼠的卵母细胞取卵数目更多。然而,突变小鼠的卵巢反应随着年龄的增长而下降,到12周时没有显著差异。同时,作者假设突变小鼠的卵巢储备也随着年龄的增长而减少。为了验证这一假设,比较了突变和野生小鼠在出生后第1天(postnatal day 1,PD1)和第3,4,12和16周各级卵泡卵泡数量。这些数据表明突变小鼠与野生小鼠在PD1的原始卵泡数量没有显著差异。总体而言,这些数据显示突变小鼠模型中卵泡出现过度激活,并且闭锁卵泡的数量随着年龄增加而增加(图1)。
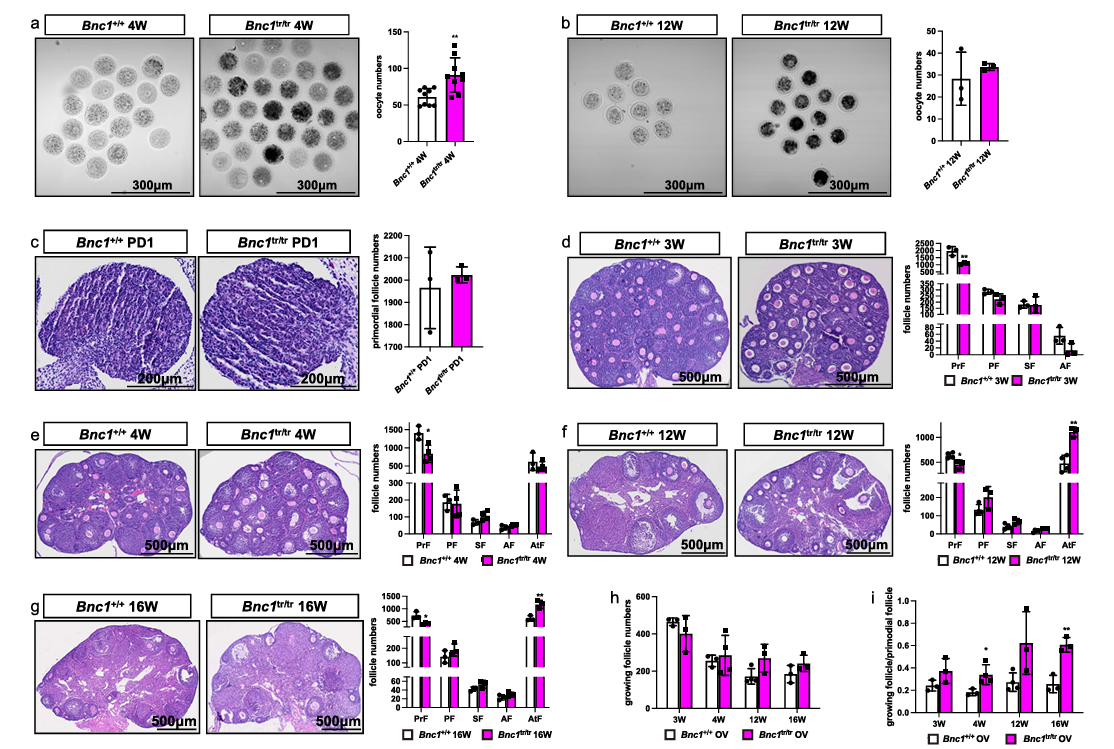
图1.BNC1缺陷诱导卵泡过度活化和闭锁导致POI表型
2. 条件性敲除卵母细胞中的BNC1引起过度激活和卵泡闭锁诱导POI
作者进一步为了探索BNC1在卵母细胞中的作用,将 BNC1loxP/loxP小鼠与Gdf-9Cre小鼠以及Ddx4Cre小鼠进行杂交后,构建小鼠卵母细胞特异性地敲除BNC1模型。BNC1loxP/loxP,Ddx4Cre (+)和 BNC1loxP/loxP,GDF9Cre(+)小鼠的卵巢/体重在36周时显著轻于WT小鼠,并且BNC1loxP/loxP,Ddx4Cre (+)和 BNC1loxP/loxP,GDF9Cre (+)的雌性小鼠中出现不孕。组织形态学分析显示,与WT小鼠的卵巢相比,BNC1loxP/loxP,Ddx4Cre (+)和 BNC1loxP/loxP,GDF9Cre (+)雌性小鼠的卵巢中的卵泡数量减少。这一表型提示BNC1在卵母细胞中起作用,并在原始卵泡阶段发挥作用,BNC1功能缺失可诱发POI。对超促排的4周和12周龄小鼠中收集到的GV卵母细胞进行计数发现,与WT小鼠相比,BNC1loxP/loxP,GDF9Cre (+)小鼠中卵泡生成的存在动态变化,并且卵巢反应与BNC1tr/tr小鼠中的一致。接着,对4和16周的BNC1loxP/loxP,GDF9Cre (-)和BNC1loxP/loxP,GDF9Cre (+)小鼠进行各级卵泡计数,发现分别在4周和16周时原始卵泡数量减少,卵泡过度激活和卵泡闭锁增加。总的来说,以上结果表明在卵母细胞特异性BNC1基因敲除小鼠中卵泡被过度激活,并且闭锁卵泡的数量增加(图2)。
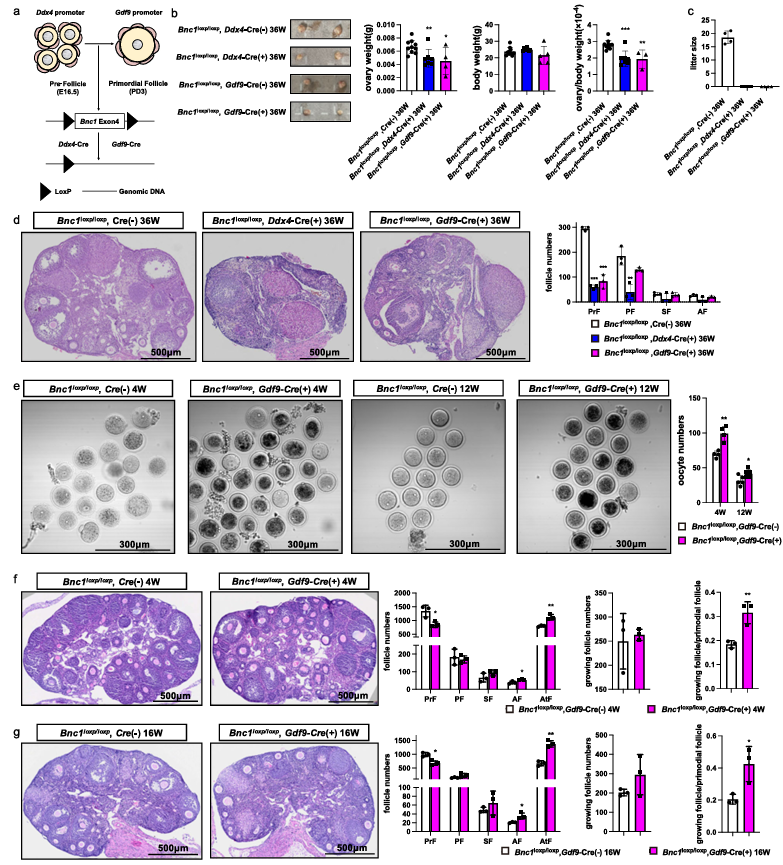
图2.条件性敲除卵母细胞中的BNC1引起过度激活和卵泡闭锁诱导 POI
3. 卵母细胞中BNC1缺陷导致非凋亡性细胞死亡的卵泡闭锁
由于细胞凋亡通常认为参与了卵泡闭锁,研究人员试图确定细胞凋亡是否参与了BNC1+/+和BNC1tr/tr小鼠的卵泡闭锁。然而,蛋白印迹实验结果分析显示,无论是在16周还是36周,突变和野生小鼠卵巢之间凋亡标志物的水平没有差异。此外,还评估了卵母细胞是否存在细胞凋亡。然而,结果表明,BNC1突变鼠和特异性敲除的卵母细胞在一定程度上存在抗凋亡作用。Annexin V染色也显示,与WT小鼠卵母细胞相比,BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞的早期凋亡没有差异。类似地,BNC1+/+和 BNC1tr/tr小鼠卵母细胞与 BNC1loxP/loxP,GDF9Cre (-)和 BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞之间的DNA损伤标志物γH2AX和凋亡标志物caspase3也没有差异。这些结果表明,在BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠中,卵泡闭锁的过程不是由细胞凋亡介导的,可能是由非凋亡细胞死亡途径介导的(图3)。
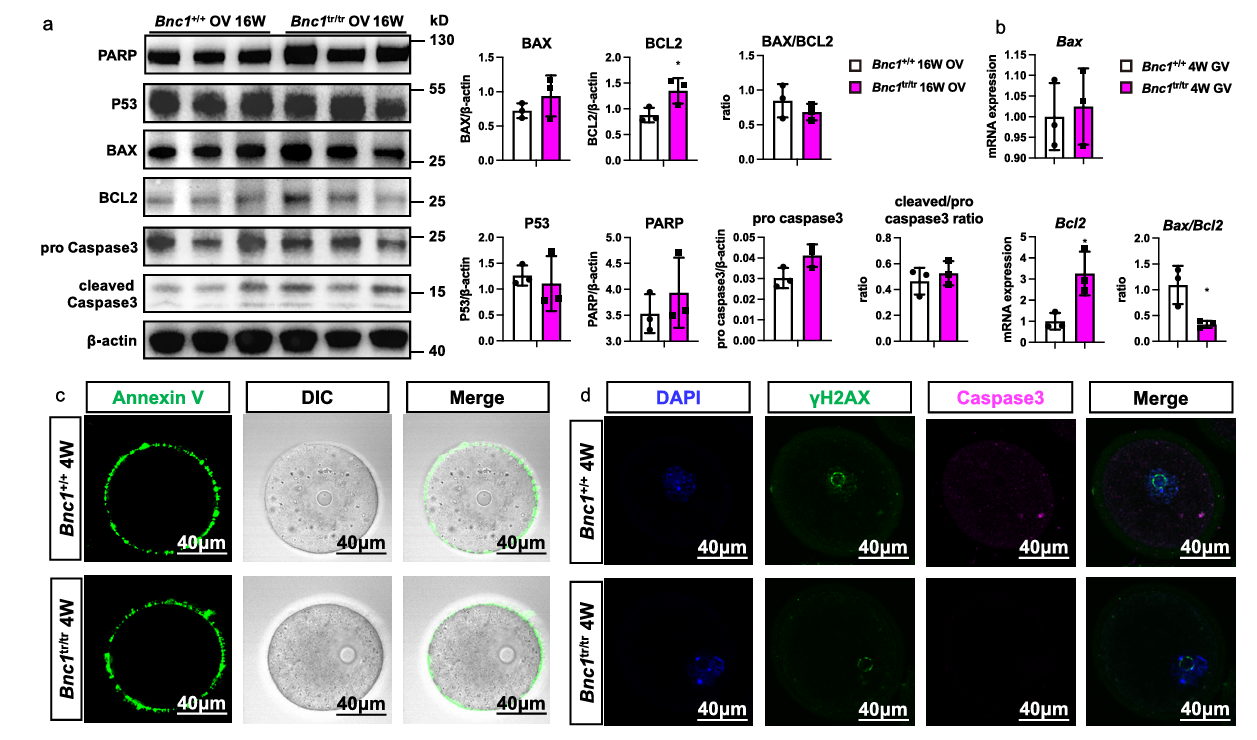
图3.卵母细胞中BNC1缺陷导致非凋亡性细胞死亡的卵泡闭锁
4. 脂质代谢异常和铁死亡与卵泡闭锁有关
为了揭示BNC1突变导致卵泡闭锁的分子机制,作者对卵巢组织进行了mRNA测序。在 BNC1+/+和 BNC1tr/tr小鼠卵巢之间有523个差异表达基因。KEGG通路富集分析和基因组变异分析显示基因功能富集在线粒体功能异常和脂质代谢受损相关通路上。而且,卵母细胞Smart-seq测序提示在BNC1+/+和 BNC1tr/tr小鼠卵母细胞之间有4554个DEG。基因组变异分析揭示了涉及BNC1tr/tr小鼠卵泡闭锁的几个重要途径,包括Hippo途径和铁死亡。线粒体介导的脂质过氧化在铁死亡中是至关重要的,Hippo途径促进铁死亡。铁死亡是一种铁和活性氧(Reactive Oxygen Species, ROS)依赖的调节性细胞死亡。脂质过氧化产物和ROS已被发现在铁死亡过程中积累。这些发现表明铁死亡可能参与BNC1突变导致卵泡闭锁的过程(图4)。
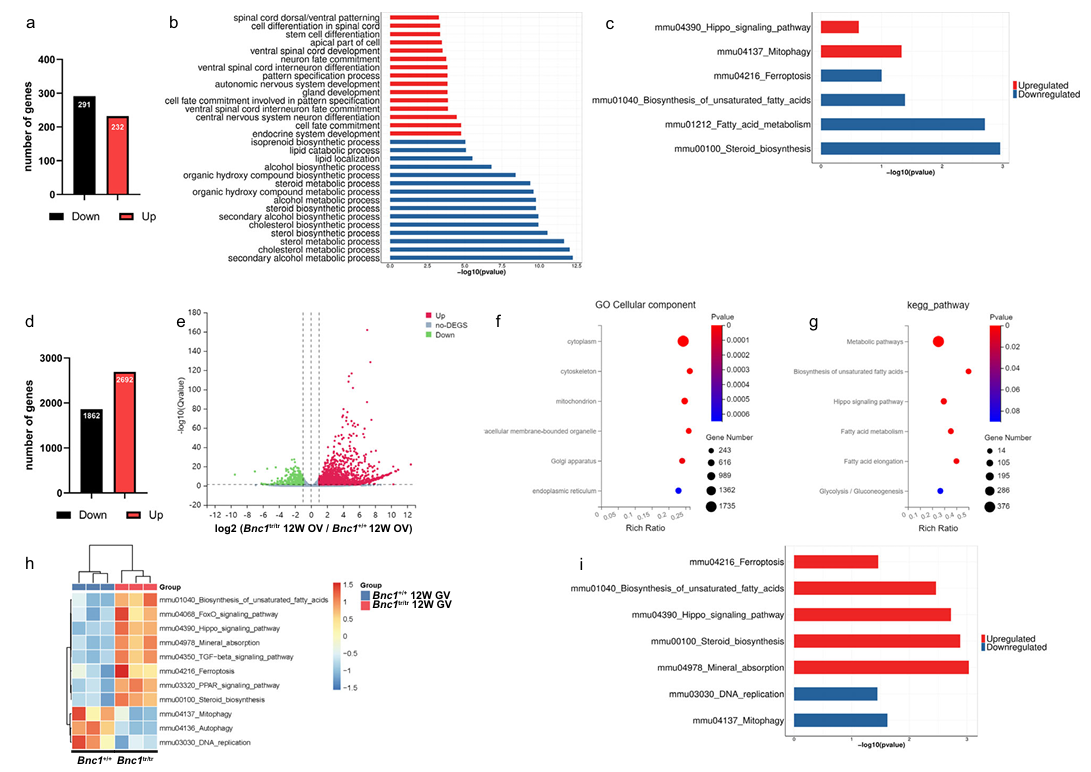
图4. 脂质代谢异常和铁死亡与卵泡闭锁有关
5. BNC1缺陷引起的卵泡闭锁受铁死亡调节
为了解决BNC1缺陷是否触发卵母细胞铁死亡的问题,研究人员对BNC1突变小鼠卵母细胞中铁死亡的形态学标志物进行了评估。首先对小鼠卵巢进行透射电镜观察,对小鼠GV期卵母细胞进行扫描电镜观察。发现 BNC1缺陷诱导了过量的脂质积累,观察到线粒体分布以及聚集异常,线粒体膜密度增加。GV期卵母细胞和小鼠卵巢的尼罗红染色也证实,在BNC1突变和敲除后卵母细胞中脂质积累。此外,作者检测了线粒体功能和氧化应激标记物的水平,包括ROS、MitoSOX、MitoTracker和JC-1。发现与 WT 小鼠卵母细胞相比,BNC1tr/tr小鼠卵母细胞和 BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞中的ROS和MitoSOX 水平显着增加。在来自BNC1tr/tr小鼠和BNC1loxP/loxP, GDF9Cre (+)小鼠的卵母细胞中发现线粒体分布缺陷,线粒体位于细胞膜下。JC-1染色显示BNC1tr/tr和BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞中线粒体膜电位显着增加,进一步表明BNC1缺陷与铁死亡相关。来自BNC1tr/tr和BNC1loxP/loxP,GDF9Cre (+)小鼠的卵母细胞也表现出脂质过氧化显着增加,这是铁死亡的关键驱动因素。
此外,BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞中谷胱甘肽过氧化酶4(Glutathione Peroxidase 4,GPX4)的表达水平降低,进一步表明BNC1突变和敲除使卵母细胞对铁死亡敏感。NAPDH氧化酶1(Nox1)和环氧化物酶2(Cox2)高度表达,这表明在BNC1tr/tr小鼠卵巢和卵母细胞中存在失调的氧化应激。在来自BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠的卵母细胞中,铁死亡标记基因如Alox12,Aloxe3, Lpcat3,Slc3a2,Slc7a11的表达显着升高。此外,铁死亡激动剂RLS3显着增强了BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞的脂质过氧化。同时,铁死亡拮抗剂(Ferrostatin-1,Fer-1)部分逆转了BNC1tr/tr和BNC1loxP/loxP,GDF9Cre (+)小鼠卵母细胞中BNC1缺陷诱导的脂质过氧化。总的来说,这些结果表明BNC1突变和特异性敲除的卵母细胞能够诱导铁死亡(图5)。
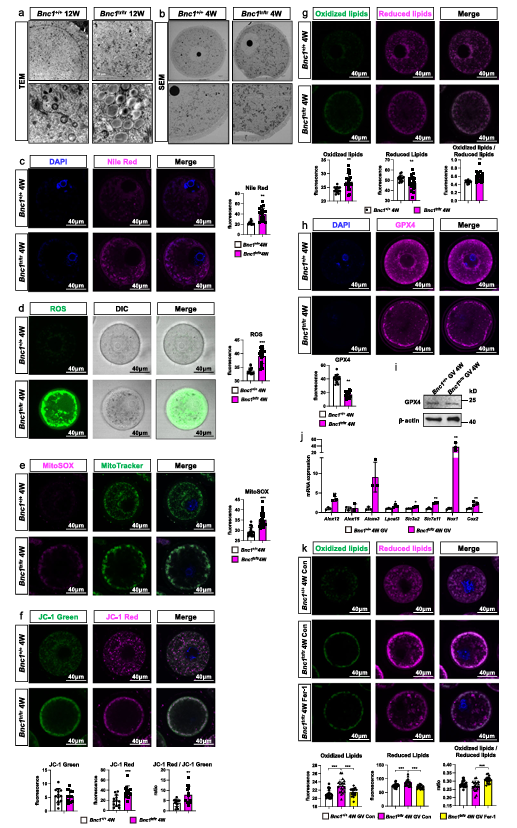
图5. BNC1缺陷引起的卵泡闭锁受铁死亡调节
6. BNC1缺陷通过 NF2-YAP 途径引发卵母细胞铁死亡
为了进一步探究BNC1缺陷诱导铁死亡的调节机制,研究人员进行了染色质免疫沉淀测序(ChIP-Seq)。发现神经纤维瘤蛋白2(Neurofibromatosis typeⅡ,NF2)可能是BNC1的靶基因。既往已经发现NF2的敲低和Hippo途径的激活促进了铁死亡。因此,作者接下来进一步研究BNC1缺陷是否通过调节卵母细胞中的NF2诱导铁死亡。ChIP-qPCR和荧光素酶活性检测证实了BNC1与NF2启动子区的结合。此外,启动子缺失测定确定了一个片段(bp-1至-500)作为BNC1调节NF2所需的区域。然后,通过卵母细胞中的免疫荧光和卵巢中的免疫组织化学检测了NF2、活性转录共激活因子相关蛋白(YAP)和运铁蛋白受体(Tfrc)的表达水平。发现与WT小鼠相比,BNC1tr/tr和BNC1loxP/loxP,GDF9Cre (+)小鼠的卵母细胞中NF2表达显着降低。在BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠的卵母细胞中YAP的核定位和下游基因Tfrc和ACSL4的表达显着增加。来自 BNC1tr/tr和 BNC1loxP/loxP,GDF9Cre (+)小鼠的卵母细胞中NF2,Tfrc,ACSL4的mRNA表达和 NF2,活性YAP,p-YAP,YAP,ACSL4和Tfrc的蛋白质表达显示与上述结果相同的趋势。鉴于Fe2+在脂质过氧化和铁死亡中的作用,研究人员使用Fe2+选择性荧光探针FerroOrange测定Fe2+的水平。共聚焦成像显示BNC1tr/tr小鼠卵母细胞中的FerroOrange强度显着强于WT小鼠的卵母细胞。含多元不饱和脂肪(PUFA)的磷脂(PUFA-PLs)过度依赖铁的过氧化作用诱导铁死亡。靶向脂质组学显示BNC1tr/tr小鼠中的磷脂酰乙醇胺(PE)(18:1/18:2) ,PE (16:0/20:4) ,PE (18:2/18:2) ,PE (18:1/20:4) ,磷脂丝氨酸(PS)(14:0/20:4)和磷脂酰肌醇(PI)(18:0/18:2)水平高于WT小鼠,表明在BNC1突变后卵母细胞用于过氧化的脂质底物的水平增加。此外,观察到溶血磷脂酰乙醇胺(LPE)(20:4)水平升高和磷脂酸(PA)(20:0/18:1)水平降低。这些分子均与铁死亡有关。上述结果表明,BNC1靶向NF2介导Hippo-YAP通路,参与调节铁死亡(图6)。
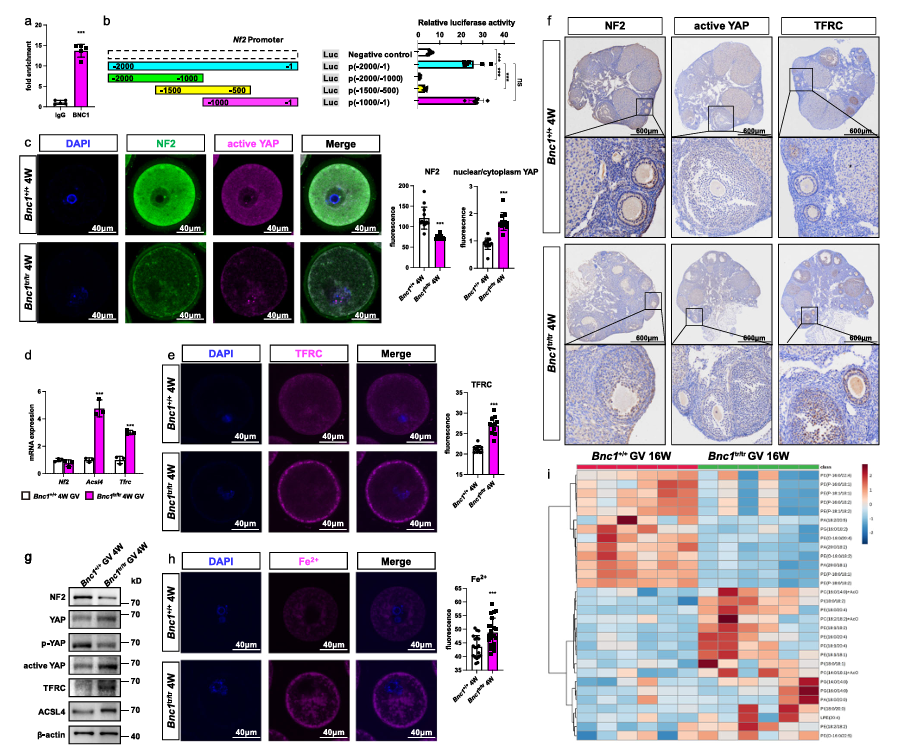
图6. BNC1缺陷通过 NF2-YAP 途径引发卵母细胞铁死亡
7. 靶向 NF2-Hippo/YAP信号转导挽救BNC1突变诱导的铁死亡
为了进一步研究BNC1对NF2的调控作用,研究人员将NF2 mRNA微量注射到GV期卵母细胞中,体外共培养24小时。然后,通过卵母细胞中的免疫荧光检测了NF2和活性YAP的表达水平。发现补充NF2 mRNA后,BNC1tr/tr小鼠卵母细胞中NF2的表达显著增加。细胞核YAP水平显著降低。接下来,作者检测了其特异性抑制剂维替泊芬(Verteporfin,VP)靶向YAP的作用。小鼠从出生后7天每隔3天注射VP(100mg/kg)+玉米油14天。与BNC1tr/tr小鼠相比,注射VP的BNC1tr/tr小鼠显示原始卵泡数量增加和卵泡过度活化减少,这些结果与在BNC1+/+小鼠中观察到的结果相一致。免疫组织化学测定显示BNC1tr/tr小鼠卵巢中TFRC和COX2的表达高于BNC1+/+小鼠。有趣的是,VP部分回调了BNC1tr/tr小鼠卵巢中的TFRC和COX2表达。随后在GV期卵母细胞中检测到TFRC 表达和Fe2+水平,发现用VP处理的BNC1tr/tr小鼠中TFRC表达降低。在VP处理的BNC1tr/tr小鼠卵母细胞中Fe2+水平也降低。在体外,ES-2细胞中BNC1的敲低导致NF2的下调和磷酸化YAP以及活性YAP,Tfrc和ACSL4的上调。这些结果进一步证实BNC1靶向NF2-Hippo-YAP-Tfrc/ACSL4通路,该通路可诱导铁死亡。与 BNC1tr/tr小鼠相比,用VP处理的BNC1tr/tr小鼠的卵母细胞显示出显著降低的脂质ROS水平(图7)。
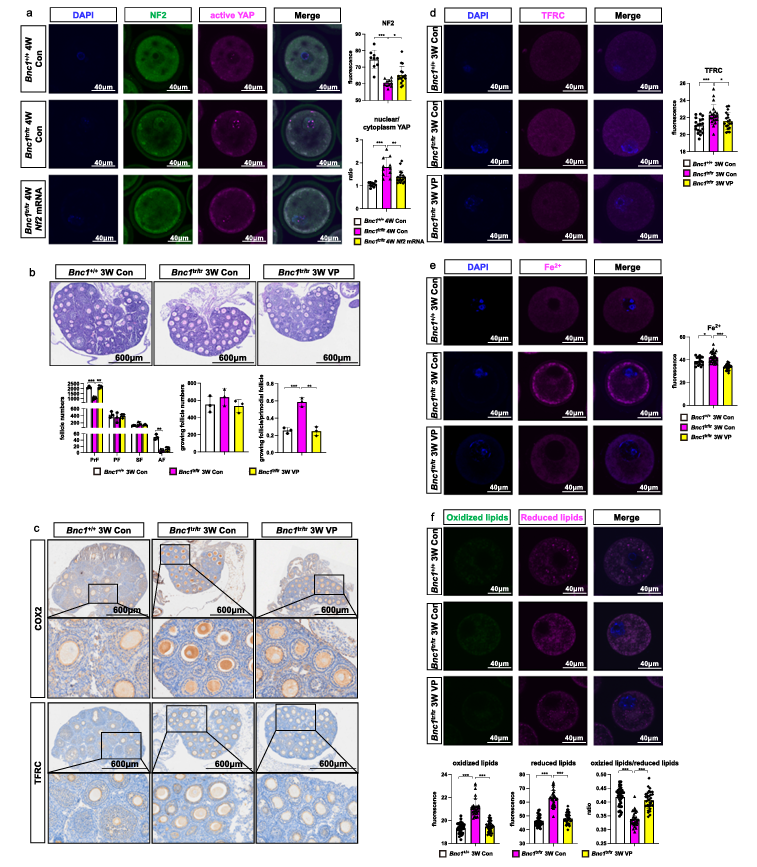
图7. 靶向 NF2-Hippo/YAP信号转导挽救BNC1突变诱导的铁死亡
8. 抑制铁死亡可改善BNC1突变导致的POI
最后,研究人员探讨了BNC1tr/tr小鼠的铁死亡是否直接诱导POI,以及是否可以通过铁死亡抑制剂Fer-1减轻这种损伤。作者将Fer-1腹腔注射到 BNC1+/+小鼠和BNC1tr/tr小鼠体内,对照组注射相同剂量的DMSO。BNC1tr/tr小鼠的卵巢重量低于BNC1+/+小鼠。有趣的是,Fer-1处理显着将BNC1tr/tr小鼠的卵巢重量恢复到正常水平。此外,Fer-1处理后 BNC1tr/tr小鼠的闭锁卵泡数量与BNC1+/+对照小鼠相当。在评估发情周期时,与 BNC1+/+小鼠相比,BNC1tr/tr小鼠表现出紊乱的发情周期,动情期延长,但Fer-1处理部分改善了这种情况。此外,Fer-1处理的BNC1tr/tr小鼠的氧化脂质和还原脂质水平显着低于BNC1tr/tr对照小鼠,表明抑制铁死亡可改善脂质代谢。免疫组织化学测定显示,BNC1tr/tr对照小鼠卵泡中GPX4表达显着降低,COX2表达高于BNC1+/+小鼠卵泡。然而,BNC1tr/tr小鼠的 Fer-1处理减弱了GPX4和 COX2表达的差异(图8)。

图8. 抑制铁死亡可改善BNC1突变导致的POI
总结与分析
1. 科学问题来源临床,研究结果服务临床,临床意义佳。研究思路非常完整,逻辑很缜密。
2. 研究结果提供了POI中卵母细胞死亡的发生机制,并提供了铁死亡靶向治疗POI的可能启示。
3. 研究通过基因突变小鼠以及卵母细胞特异性敲除小鼠模型开展研究,进一步验证铁死亡在BCN1缺陷诱导POI的作用。故事完整,从发现目标基因-基因导致表型-具体作用机制-到潜在治疗靶点。
4. 对于研究卵母细胞或者颗粒细胞非凋亡途径的论证提供了较好的研究范例。
原文链接:https://www.nature.com/articles/s41467-022-33323-8
参考文献:
1. Webber, L. et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum. Reprod. 31, 926–937 (2016).
2. Stockwell, B. R., Jiang, X. & Gu, W. Emerging mechanisms and disease relevance of ferroptosis. Trends Cell Biol. 30, 478–490 (2020).
3. Zhang, S. et al. Advances in biomaterials and regenerative medicine for primary ovarian insufficiency therapy. Bioact. Mater. 6, 1957–1972 (2021).
4. Goswami, D. & Conway, G. S. Premature ovarian failure. Hum. Reprod. Update 11, 391–410 (2005).
5. Persani, L., Rossetti, R. & Cacciatore, C. Genes involved in human premature ovarian failure. J. Mol. Endocrinol. 45, 257–279 (2010).
6. Rossetti, R., Ferrari, I., Bonomi, M. & Persani, L. Genetics of primary ovarian insufficiency. Clin. Genet 91, 183–198 (2017).
7. Takahashi, A., Yousif, A., Hong, L. & Chefetz, I. Premature ovarian insufficiency: pathogenesis and therapeutic potential of mesenchymal stem cell. J. Mol. Med (Berl.) 99, 637–650 (2021).
8. Jagarlamudi, K. et al. Oocyte-specific deletion of Pten in mice reveals a stage-specific function of PTEN/PI3K signaling in oocytes in controlling follicular activation. PLoS One 4, e6186 (2009).



