Cell:KDM6B调控小鼠早孕期子宫成纤维细胞H3K27me3修饰影响分娩时序
加州大学旧金山分校Adrian Erlebacher团队于2025年1月21日在Cell发表研究"KDM6B-dependent epigenetic programming of uterine fibroblasts in early pregnancy regulates parturition timing in mice",该研究揭示了分娩时机的调控不仅依赖妊娠晚期的近端触发信号,更与妊娠初期的表观遗传重编程密切相关。既往关于分娩时机的调控研究多聚焦孕晚期激素变化,而在本研究中,研究者发现妊娠早期子宫成纤维细胞通过组蛋白去甲基化酶KDM6B调控H3K27me3水平,启动关键基因座表观遗传程序。这种决定基因表达的早期编程时空模式能够引发妊娠中晚期基因错误表达,继而导致分娩延迟。此外,除KDM6B主导的快速表观调控外,植入后还存在另一独立于KDM6B的渐进性H3K27me3修饰过程,二者协同影响分娩时机。该研究首次揭示子宫微环境在妊娠早期建立的表观遗传“记忆”对分娩时序的远程调控,为早产机制提供了新视角,提示干预窗口可能需前移至妊娠初期。
研究背景
哺乳动物分娩启动的分子机制至今尚未完全阐明,核心争议在于:分娩时序是由贯穿妊娠全过程的“生物计时器”程序化控制,还是仅由妊娠末期自动触发的信号(如胎儿/胎盘发育副产物)所决定?这一问题的解答对早产机制研究至关重要——若存在早期程序化计时机制,则提示部分早产可能源于妊娠初期计时系统的异常。
现有小鼠模型研究表明,分娩终末级联反应由子宫内事件触发:妊娠末期子宫腔上皮细胞通过诱导前列腺素合成酶COX-1(由Ptgs1编码)产生PGF2α,进而作用于卵巢黄体细胞,促使孕酮(P4)代谢酶20α-HSD(由Akr1c18编码)表达,引发孕酮水平骤降(黄体溶解),最终激活子宫肌层收缩。然而,触发PGF2α产生的上游信号及妊娠时限控制机制仍属未知[1-5]。表观遗传调控尤其是H3K27me3动态修饰(由Polycomb复合体PRC2甲基化、KDM6A/B去甲基化协同调控)在细胞命运决定中的作用已被广泛认知。近期研究提示该修饰可能参与妊娠晚期子宫功能转化,但其在分娩时序调控中的直接作用尚未探索。
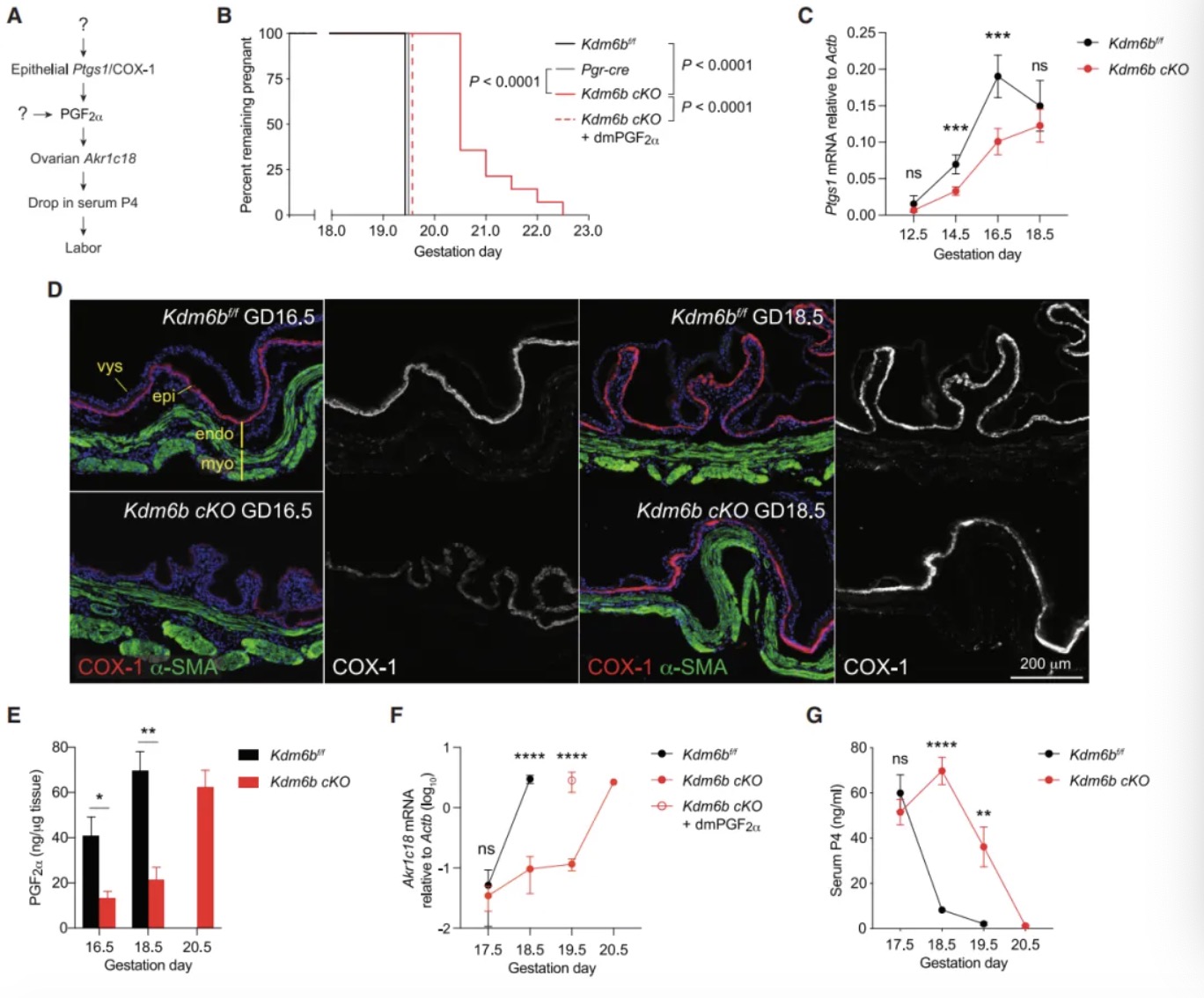
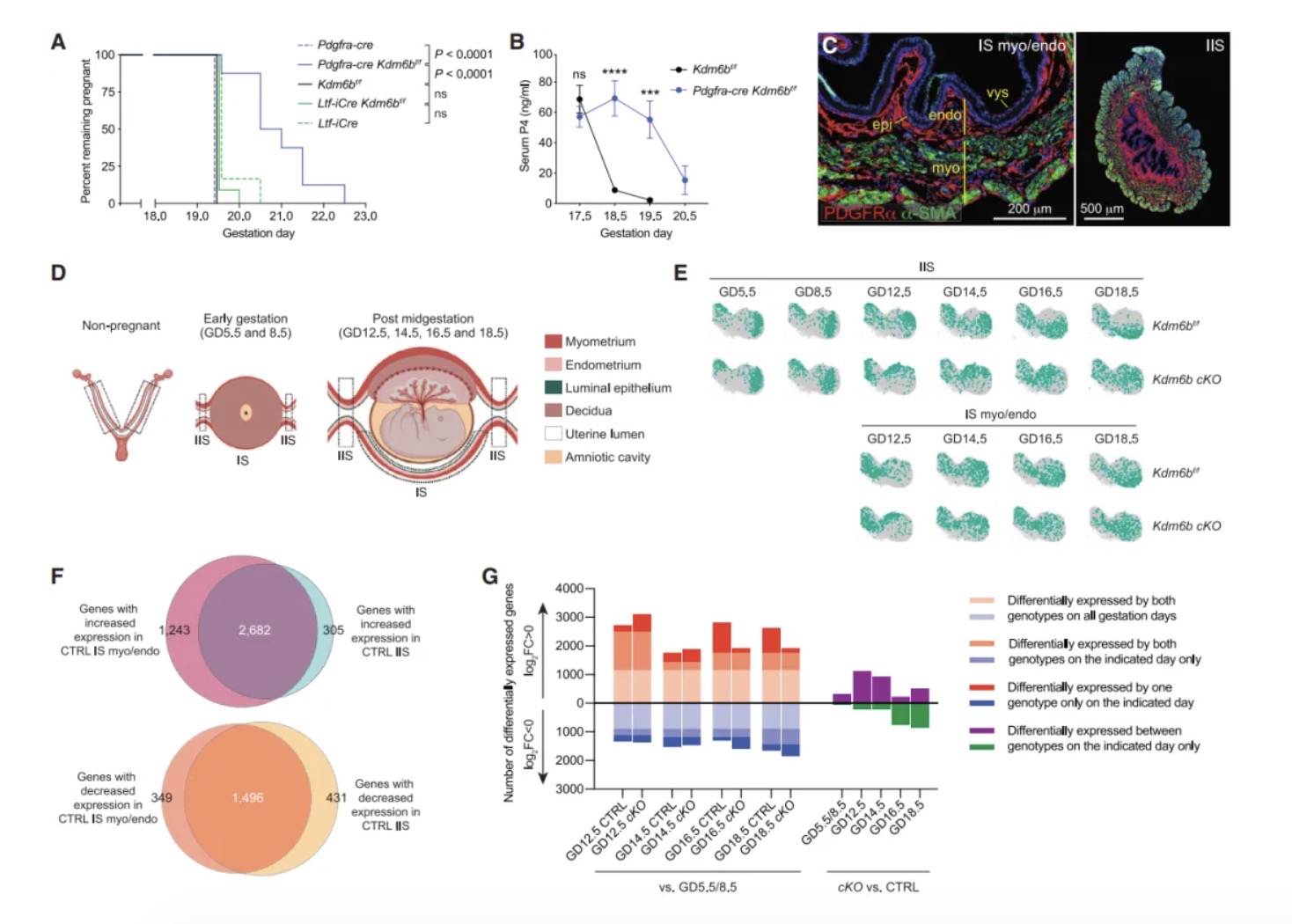
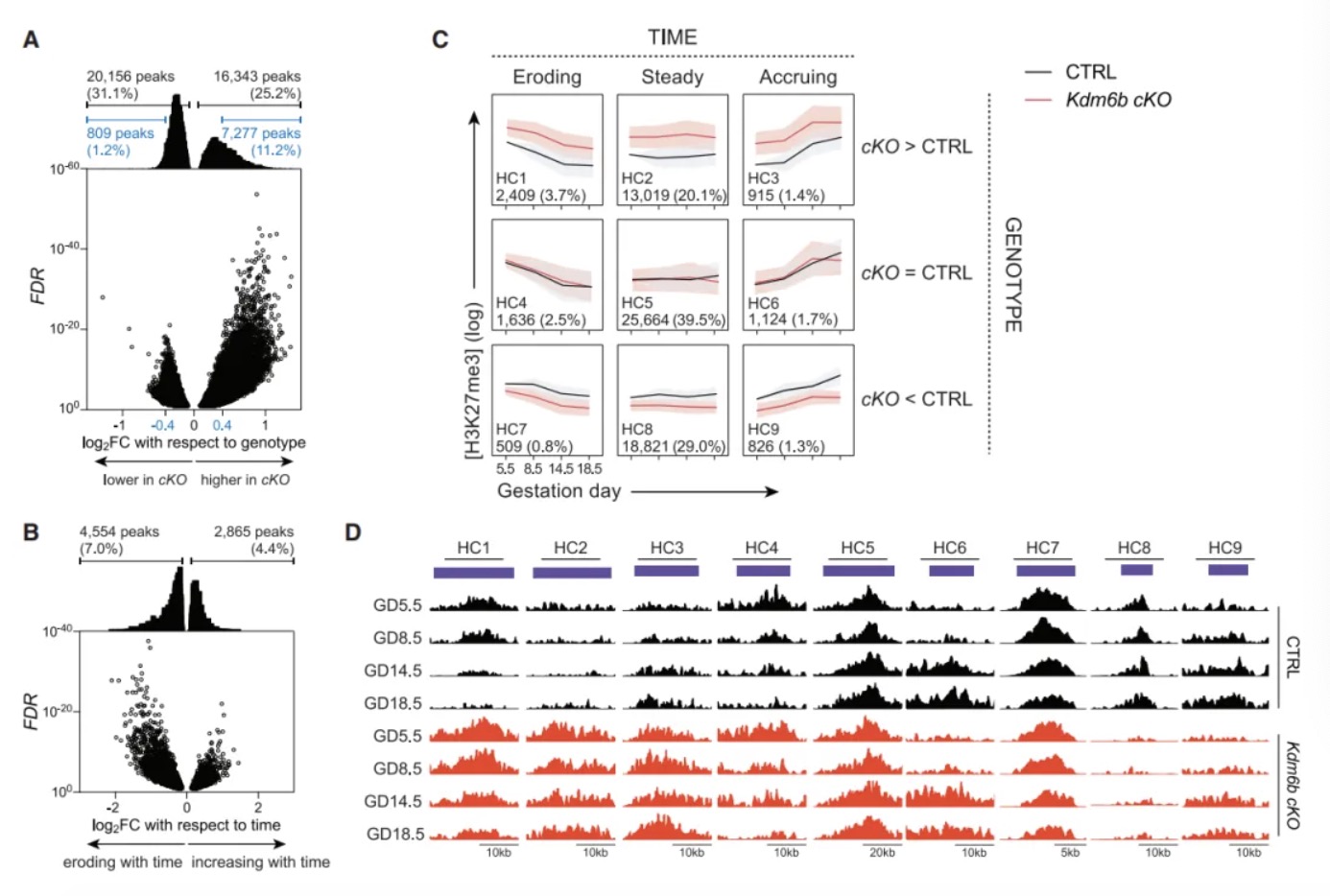
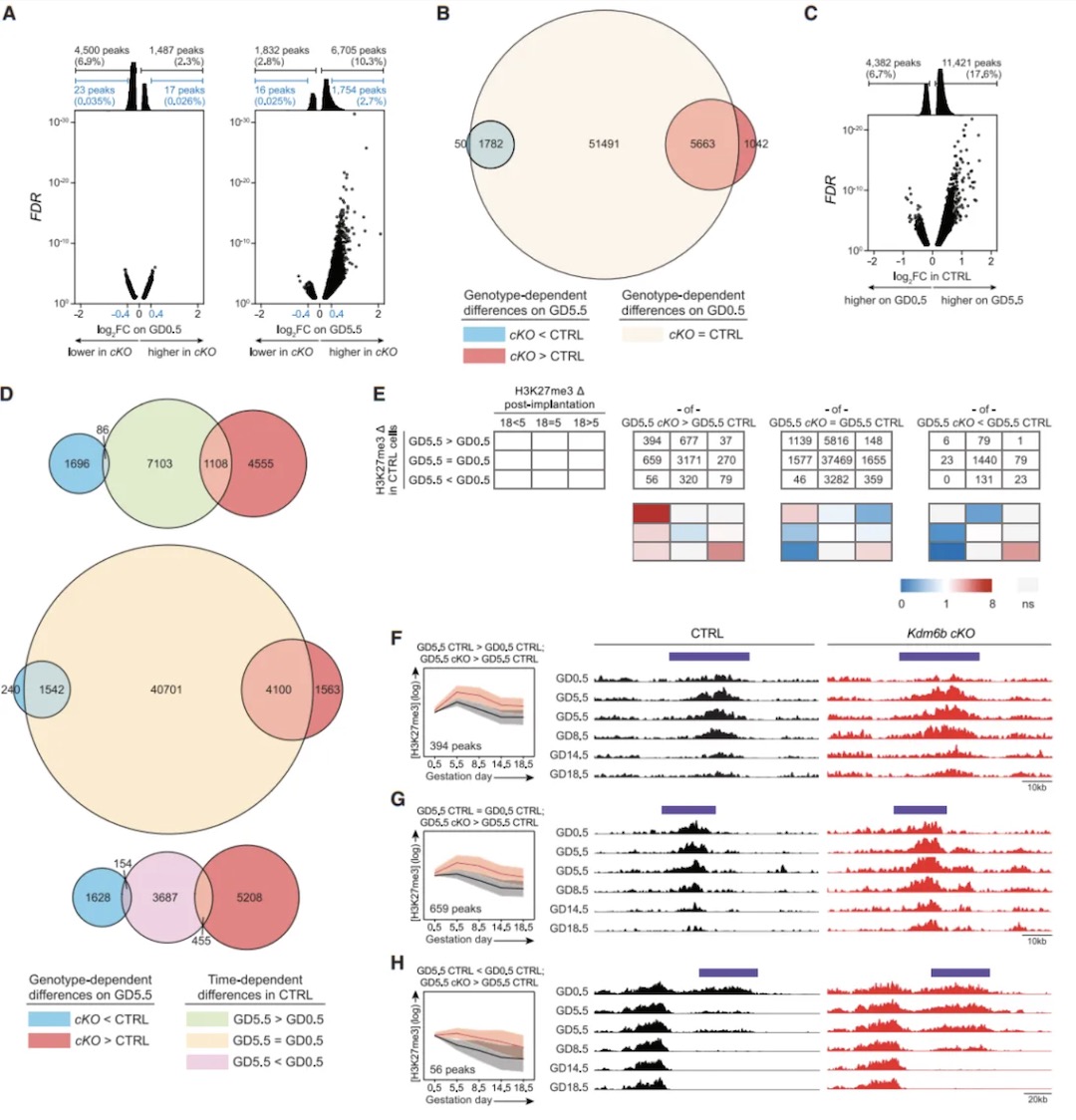
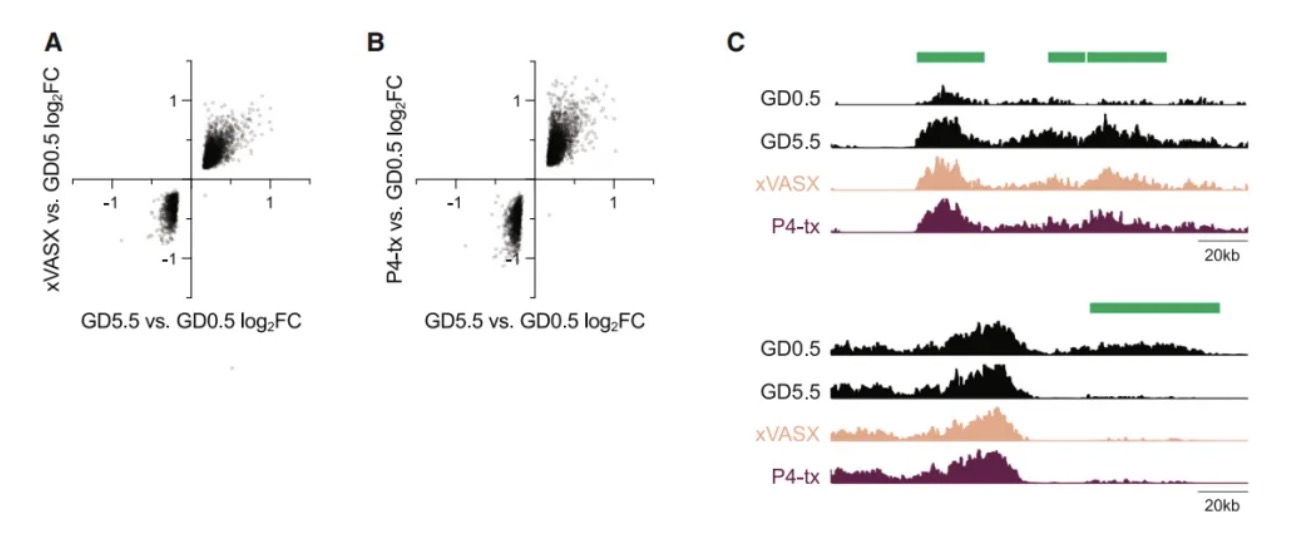
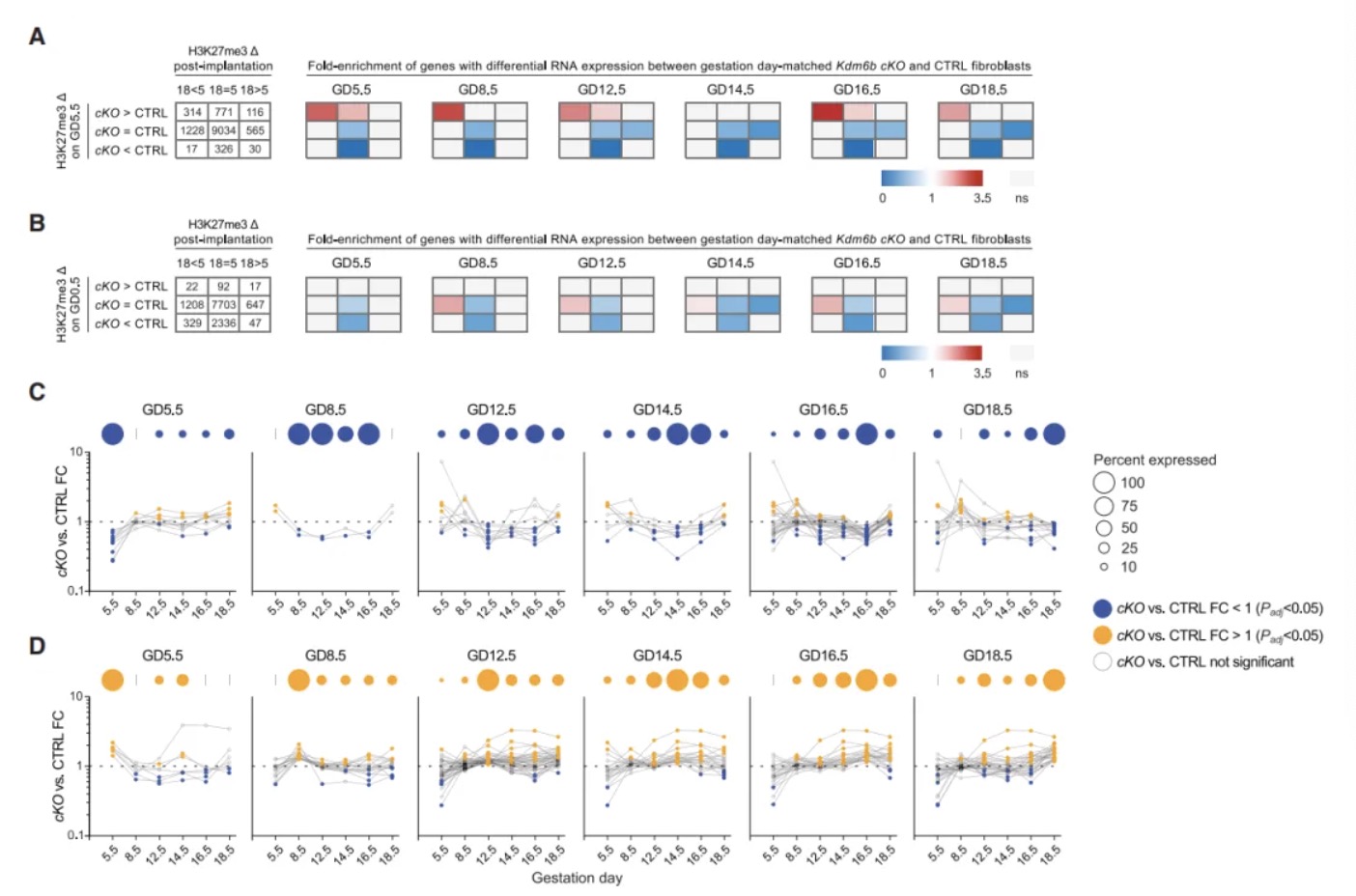
研究内容 1. KDM6B是小鼠分娩时序正常化的必需因子 作者团队首先构建了两种特异性敲除小鼠模型:Pgr-cre Kdm6af/f和Pgr-cre Kdm6bf/f(以下简称Kdm6b cKO)。实验发现Kdm6a敲除导致早期妊娠失败,而Kdm6b cKO小鼠虽能完成妊娠,但分娩时间较对照组(正常B6品系小鼠妊娠19.5天分娩)延迟1-3天(图1B)。通过分子检测发现,Kdm6b cKO小鼠子宫上皮细胞的Ptgs1 mRNA诱导受阻,导致COX-1蛋白表达延迟,进而影响PGF2α合成(图1C-E)。这种信号传递缺陷进一步引发卵巢Akr1c18 mRNA诱导滞后,使血清孕酮水平在GD18.5后仍维持高位,而对照组此时已下降(图1F-G)。为明确机制特异性,研究者进行卵巢移植实验,发现将Kdm6b cKO小鼠卵巢移植至Kdm6af/f受体后,分娩时间仍由受体基因型决定,证实分娩时间并非源于卵巢Kdm6b功能异常(图S1A)。当研究者对Kdm6b cKO GD18.5小鼠给予外源性PGF2α类似物注射后,发现其可有效激活Akr1c18表达(图1F)并在24小时内诱导分娩(图1B),证明Kdm6b cKO GD18.5小鼠卵巢应答机制完整。此外,Kdm6b cKO小鼠胚胎着床时间、胎儿生长速率及胎盘发育等参数与对照组无显著差异,排除了胚胎源性干扰因素[6, 7]。这些发现共同表明,KDM6B通过调控子宫固有的PGF2α合成通路——而非卵巢或胚胎相关机制——精确控制分娩启动时序,其功能缺陷直接导致孕酮撤退延迟和分娩滞后。 图1:Kdm6b cKO 小鼠因为黄体溶解延迟而出现了分娩延迟 2. 分娩时序正常化依赖子宫成纤维细胞的KDM6B功能 为明确KDM6B在子宫不同细胞类型中的功能特异性,研究者构建了两种条件性敲除小鼠:利用Ltf-iCre[8]特异性敲除子宫上皮细胞的Kdm6b,以及通过Pdgfra-cre[9]靶向敲除PDGFRα阳性成纤维细胞的Kdm6b。结果发现,上皮细胞特异性敲除小鼠的分娩时间与对照组无差异(图2A),而成纤维细胞敲除小鼠(Pdgfra-cre Kdm6bf/f)完全复现了Kdm6b cKO小鼠的表型——分娩延迟1-3天、黄体溶解滞后及子宫上皮Ptgs1/COX-1诱导缺陷(图2A-B)。这一结果首次揭示PDGFRα阳性成纤维细胞通过KDM6B依赖的机制,在妊娠晚期精确调控邻近的腔上皮细胞COX-1的诱导,从而确保分娩时序正常。值得注意的是,Kdm6b cKO小鼠子宫着床位点间区域(inter-implantation sites, IIS)出现异位蜕膜瘤,但Pdgfra-cre Kdm6bf/f小鼠无此表型,证实该结构与分娩延迟无因果关联。 进一步通过单细胞转录组测序(scRNA-seq)纵向分析发现:在正常小鼠中,IIS区域的成纤维细胞从GD5.5至GD8.5保持转录稳态,GD12.5后进入持续转录重编程状态;而着床位点肌内膜(IS myo/endo)成纤维细胞从GD12.5至GD18.5也呈现渐进性基因表达演变(图2E)。尽管解剖位置不同,GD12.5后两区域成纤维细胞在基因调控程序上高度保守(图2F),提示存在跨区域的协同调控网络。Kdm6b cKO成纤维细胞在GD12.5后出现显著的转录偏移(图2E),差异基因分析显示其基因表达动态虽与对照组共享1,159个上调基因和868个下调基因(图2G),但存在22-90倍的基因表达紊乱,且随时间推移出现15个持续差异表达基因。这表明在妊娠中期之后,KDM6B缺失主要干扰了基础转录程序上的精细调控层——该基础程序本身由GD8.5启动且独立于KDM6B,其执行与子宫上皮Ptgs1的泛诱导期(GD14.5后)同步。值得注意的是,Kdm6b cKO小鼠中这一上皮细胞状态转变过程受损,直接关联于分娩启动信号的延迟。 图2:子宫成纤维细胞KDM6B的表达控制着分娩时机 3. H3K27me3动态修饰在着床后子宫成纤维细胞中具有位点特异性和KDM6非依赖性 为解析Kdm6b敲除导致分娩延迟的表观遗传基础,研究者对妊娠期小鼠子宫成纤维细胞进行CUT&RUN表观组学分析。实验聚焦于两类邻近上皮细胞的成纤维细胞——着床位点间区域(IIS)和着床位点肌内膜(IS myo/endo)(图2D),纵向追踪从GD5.5至GD18.5的H3K27me3修饰动态。结果显示,Pdgfra-cre Kdm6bf/f(特异性敲除成纤维细胞Kdm6b)与Kdm6b cKO(全子宫敲除)小鼠在GD14.5的H3K27me3修饰谱高度一致(64,923个峰中仅54个差异峰),证实成纤维细胞的表观动态不受上皮细胞KDM6B状态影响。进一步分析发现,正常小鼠中H3K27me3修饰呈现两种核心模式:其一为时间依赖性渐进修饰,从GD5.5至GD18.5,全基因组11.4%的峰呈现持续强度减弱或增强(图3A和3B),且该过程自GD8.5后呈单向渐进,例如56.3%的峰在Kdm6b cKO中显著改变,其中11.2%的峰强度异常升高(log2FC>0.4),符合KDM6B作为去甲基化酶的功能特征;其二为位点特异性非KDM6B依赖调控,尽管敲除导致部分位点H3K27me3异常累积,但时间依赖性修饰模式(如GD12.5后特定基因座的渐进性H3K27me3丢失)在敲除组与对照组中高度保守。通过聚类分析将64,923个峰划分为9种动态类别HC1-9(图3C和3D),揭示基因组不同区域存在协同或拮抗的调控模式,例如部分基因座在妊娠早期即建立KDM6B依赖的修饰框架,而另一些位点则在妊娠中后期通过独立于KDM6B的渐进修饰完成动态重塑。 上述这些发现表明,子宫成纤维细胞的H3K27me3动态由双重机制调控:妊娠早期(GD5.5前)通过KDM6B介导的位点特异性修饰建立基础框架,而GD8.5后启动的渐进性修饰——独立于KDM6B——则主导妊娠中晚期基因表达的时序性激活。这种分层调控模型解释了为何Kdm6b敲除仅导致部分基因异常表达,而基础分娩程序仍能执行。 图3:着床后子宫成纤维细胞的H3K27me3的改变模式 4. KDM6B参与早孕期子宫成纤维细胞基因组的H3K27me3的调控 为揭示KDM6B在妊娠早期对H3K27me3动态的调控作用,研究者对交配后12小时(GD0.5)和GD5.5的子宫成纤维细胞进行H3K27me3 CUT&RUN分析。结果显示,Kdm6b cKO小鼠与对照组在GD0.5时的H3K27me3峰差异较小(图4A),但到GD5.5时,Kdm6b cKO细胞中H3K27me3峰强度显著增加,且约2.7%的峰呈现高累积(log2FC > 0.4)(图4A)。这表明,KDM6B的去甲基化功能在GD0.5至GD5.5期间发挥关键作用。进一步分析发现,GD5.5时cKO与对照组的差异峰中,84.4%的增强峰和97.2%的减弱峰在GD0.5时并无差异(图4B),提示KDM6B在此阶段通过“从头调控”建立H3K27me3的修饰框架,而妊娠中后期的H3K27me3动态则独立于KDM6B。 值得注意的是,相较于GD5.5至GD18.5,对照组孕鼠成纤维细胞在GD0.5至GD5.5期间经历了广泛的H3K27me3重塑:24.3%的峰发生强度变化(17.6%累积,6.7%丢失),显著高于GD5.5至GD18.5期间的动态比例(11.4%)(图4C)。而KDM6B缺失仅影响其中部分峰(累积峰14.4%,丢失峰12.2%),但对GD0.5至GD5.5期间稳定的峰也造成14.2%的扰动(图4D)。这些数据表明,妊娠早期存在一个由交配触发的表观遗传重编程程序,其可能通过KDM6B对特定基因座的修饰,为后续基因表达的时空模式奠定基础。 研究者进一步利用假孕模型(xVASX)和孕酮处理(P4-tx)小鼠探索H3K27me3编程的触发因素。结果显示,GD5.5时正常妊娠与假孕小鼠的H3K27me3分布高度相似(仅15个差异峰),而与P4处理小鼠的差异峰达1,754个(图5A-C)。由于假孕小鼠虽未发生胚胎植入,但仍经历交配诱导的孕酮和催乳素水平升高,提示交配行为本身(而非胚胎信号)是触发子宫成纤维细胞表观编程的主要因素,而孕酮可能在其中发挥协同作用。此外,不同遗传背景(B6CBAF1/J与B6)小鼠的H3K27me3动态在GD0.5至GD5.5期间呈现高度保守性,证实这一编程过程的普遍性。 图4:KDM6B介导妊娠早期子宫成纤维细胞全基因组范围内H3K27me3修饰强度的广泛调控 5. KDM6B构建的位点特异性的H3K27me3在GD5.5出现的差异预示着KDM6B造成的基因错误表达可能出现在妊娠中后期 为解析KDM6B在妊娠早期建立的表观遗传框架如何远程调控中后期基因表达,研究者整合scRNA-seq与CUT&RUN数据,分析H3K27me3动态与基因表达异常的关联。通过将基因与其转录起始位点10 kb内的H3K27me3峰动态类别(HC1-HC9)关联,并计算基因错误表达的富集程度,研究者们发现: 在Kdm6b cKO小鼠中,GD5.5时H3K27me3峰强度升高的基因座(尤其是GD5.5至GD18.5逐渐丢失的HC1类峰和稳定存在的HC2类峰)显著富集妊娠中后期的错误表达基因(图6A)。值得注意的是,这种关联仅存在于GD5.5建立的表观差异中,而GD0.5的H3K27me3差异无法预测后续基因表达异常(图6B)。进一步分析显示,H3K27me3异常升高不仅导致基因表达抑制,还与部分基因的异常激活相关,提示复杂调控网络的存在。 此外,妊娠中后期(GD12.5-GD18.5)错误表达的基因呈现动态变化:部分基因的表达失调在后期恢复正常或反向变化,而非持续固定(图6C-D)。例如,HC1/2相关基因中仅少数(15个)在整个妊娠期持续差异表达,多数基因的异常表达具有时间窗口特异性。这一动态模式表明,Kdm6b敲除导致的表观遗传缺陷并非通过固定基因集的持续失调引发分娩延迟,而是通过破坏妊娠不同阶段基因表达的时序性激活程序。 图5:交配行为通过H3K27me3表观编程机制调控妊娠早期发育进程 6. GD5.5后 H3K27me3逐渐丢失预示着妊娠中后期的基因表达水平上调 为揭示H3K27me3动态修饰如何调控基因表达的时序性,研究者聚焦于对照组子宫成纤维细胞中H3K27me3峰丢失(GD5.5至GD18.5)与基因激活的关联。结果显示,在正常小鼠中,邻近H3K27me3丢失峰的基因显著富集于妊娠中后期(GD12.5-GD18.5)上调表达的基因(图7A)。这种关联在IS肌内膜和IIS区域的成纤维细胞中均存在,且与两区域共享的基因诱导程序一致(图2F)。值得注意的是,这种关联部分由1,551个持续上调基因驱动(占GD12.5-GD18.5所有上调基因的41%),但即使排除这些基因后,GD14.5的关联仍显著存在。进一步时间分段分析表明,H3K27me3丢失对基因表达的调控具有持续性:GD8.5至GD18.5期间,峰丢失与基因上调的关联贯穿多个时间窗口(图7B),且约30%的基因在GD16.5达到表达峰值,提示H3K27me3动态重塑通过“滚动式”机制调控基因激活时序。 在Kdm6b cKO小鼠中,这种关联呈现基因型依赖性分层:GD5.5时H3K27me3峰强度异常升高的基因(HC1类)对妊娠中后期基因上调的预测能力最强(图7C)。火山图分析进一步显示,HC1类峰关联的基因不仅在对照组中呈现时间依赖性上调,在Kdm6b cKO中也显著错误表达(图7D-E)。例如,Postn等基因在Kdm6b cKO中表达异常,且这些基因在人类分娩期子宫肌层中同样差异表达,提示跨物种保守性。值得注意的是,这种双重关联(时间依赖性和基因型依赖性)排除了GD0.5的初始表观差异干扰,进一步明确GD0.5-GD5.5期间KDM6B的功能缺失可导致妊娠中后期的基因失调。 图6:Kdm6b条件敲除小鼠成纤维细胞在妊娠第5.5天,而非第0.5天,出现的H3K27me3水平升高与妊娠中期后相关基因的异常表达存在关联 图7:子宫成纤维细胞中H3K27me3的位点特异性消减与妊娠中期后关联基因的诱导表达存在相关性 总结与展望 该研究揭示妊娠早期(GD0.5-GD5.5)子宫成纤维细胞中KDM6B依赖的H3K27me3表观编程控制了小鼠分娩时序。交配触发的孕酮信号通过KDM6B调控H3K27me3动态:其缺失导致部分基因座H3K27me3异常累积,干扰妊娠中后期基因表达的时序性激活,最终延迟分娩。这一编程过程伴随H3K27me3甲基化/去甲基化的动态平衡。GD5.5后启动的独立于KDM6B的H3K27me3渐进性丢失进一步调控基因,其作为分子计时器解除基因抑制,确保子宫上皮PGF2α的适时合成。KDM6B缺失导致H3K27me3阈值延迟到达,基因激活滞后(如HC1类峰相关基因)。值得注意的是,部分基因异常表达可能源于H3K27me3复制稀释或其他位点表观重塑的级联效应。尽管该研究明确了KDM6B在早期编程中的核心作用,H3K27me3丢失的具体机制及成纤维细胞调控上皮PGF2α合成的通路仍待解析。此外,HC2/3类峰(非侵蚀性异常)可能通过间接调控网络影响分娩时序。提示人类分娩可能受类似机制调控:部分H3K27me3动态相关基因在临产子宫肌层差异表达,且子宫成纤维细胞可能通过免疫调节参与分娩启动。若人类早产与妊娠早期表观编程异常相关,则干预窗口需前移,这为探索特发性早产机制提供了新方向。 原文链接: https://doi.org/10.1016/j.cell.2024.12.019 小编:胡沛然