心血管疾病(CVD)是全球人口死亡的首要原因,2019年全球CVD患病人数已达5.23亿,因CVD死亡的人数达1860万[1]。高血脂便是导致CVD的危险因素之一,尤其是“坏胆固醇”——低密度脂蛋白胆固醇(LDL-C)的升高。传统降脂方法包括生活方式干预和药物治疗[他汀类药物和前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂等]已显示出一定效果。然而,面对长期管理血脂的需求,让人不禁遐想:有没有一种疗法,可以一次性解决疾病,实现永久降脂?
近日,发表在Nature Medicine上的研究介绍了一种全新降血脂策略,为我们提供了方向——通过表观遗传编辑技术靶向调控PCSK9基因表达,仅需一针即可沉默PCSK9基因,使LDL-C降低70%,效果或将持续终生(图1)。动脉粥样硬化性心血管疾病(ASCVD)作为CVD的一种主要类型,其主要驱动因素之一就是LDL-C的升高。这种“坏胆固醇”在血管中逐渐累积,导致动脉斑块的形成,进而增加了心肌梗死、卒中等严重疾病的风险。另外,在胆固醇代谢过程中,PCSK9基因扮演着至关重要的角色。该基因编码的PCSK9蛋白能促进肝细胞表面低密度脂蛋白受体(LDLR)的降解,进而减少血液中LDL-C的清除效率。因此,抑制PCSK9的功能可以显著提高LDL-C的清除率,降低其浓度,减缓动脉粥样硬化的进程。针对PCSK9这一靶点,现已研发出了PCSK9抑制剂,通过注射方式有效阻断PCSK9作用,显著降低了LDL-C水平。然而,尽管效果显著,这些药物需要长期、定期注射,依从性问题依然突出。在探索一次性降脂治疗的路程中,基因编辑有着非常重要的地位。其中,VERVE-101作为一种开创性的体内碱基编辑疗法,率先进入临床试验阶段。该药可以通过精准修改特定基因序列来实现对PCSK9基因的有效抑制,从而大幅度降低血液中的LDL-C水平,甚至可能实现一次给药、终生降脂。但这种传统的基因编辑是通过切割DNA修改遗传密码,存在脱靶效应,即意外修改非目标基因进而增加癌症的风险。本项研究则另辟蹊径,采用“表观遗传编辑器”,不改变DNA序列,仅通过甲基化这一化学修饰手段“关闭”特定基因表达。在这项研究中,团队设计了一套精准递送系统:将表观遗传编辑器(由DNA甲基转移酶DNMT3A和KRAB转录阻遏结构域等组成)通过脂质纳米颗粒精准递送至肝脏;在PCSK9基因启动子区添加甲基化标记,从而实现对PCSK9基因的沉默,降低PCSK9蛋白的表达。为了评估该技术在降低PCSK9蛋白水平及LDL-C方面的疗效,研究团队使用了携带人PCSK9基因的小鼠作为实验模型。在转基因小鼠模型中,单次注射后结果显示(图2):PCSK9蛋白减少90%,表观遗传编辑成功实现基因沉默效果;LDL-C下降70%,降幅与现有药物作用相当;沉默效果持续超1年,并且在部分肝切除术诱导的肝脏再生后完全维持。
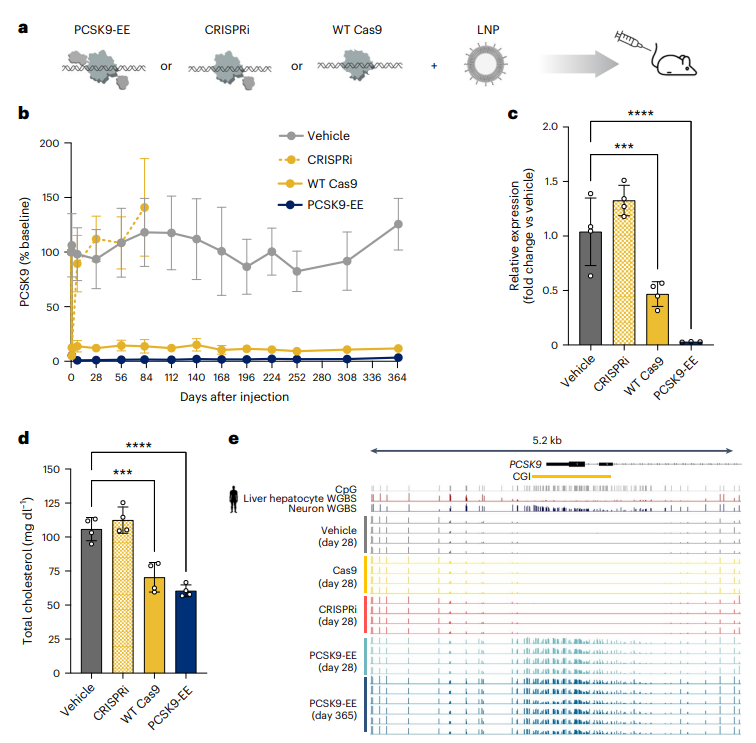
图2 PCSK9基因沉默在体内的持久性及其对肝脏DNA甲基化的影响值得一提的是,这项研究还探讨了表观遗传编辑技术的可逆性。科学家们通过另一种表观遗传激活工具,清除了PCSK9基因启动子上的甲基化,重新激活了基因表达。对比现有疗法,这种通过DNA甲基化调控PCSK9表达的新方法具有许多独特优势:不用频繁注射,DNA甲基化可稳定遗传,远超现有药物数周的有效期;不切割DNA,无基因突变风险,且PCSK9仅在肝脏表达,精准编辑避免全身副作用;甲基化标记理论上可用去甲基化酶擦除,可控性强;传统药物无效或不耐受、因遗传缺陷导致高血脂的患者都是其潜在的适用人群;对于国家还可以减轻医疗支出和医保负担。尽管前景光明,但目前需跨越的关卡仍有许多,比如如何确保甲基化不被机体自然清除?长期沉默PCSK9基因会否影响其他生理功能?人体肝脏编辑效率能否达到实验动物水平?另外,基因编辑技术无论对患者还是社会都可能引发伦理争议,需要制定完善的监管政策。从降胆固醇到治愈疾病,基因编辑技术不只限于心血管领域,DNA甲基化编辑可靶向数万种遗传异常疾病,如癌症、神经退行性疾病等。未来甚至可以开发“通用型编辑器”:输入不同靶点坐标,即可治疗不同疾病,真正实现“一针治百病”,从这里似乎可以预见表观遗传治疗时代的降临。当基因编辑从“剪切基因”升级为“调控基因”,我们或许将告别终身服药的时代。