Circulation:线粒体蛋白翻译降低可促进心肌细胞增殖与心肌再生

研究背景
成年哺乳动物心脏受损后,由于其心肌细胞不具备足够的增殖能力,因此无法实现心脏的组织修复。而新生哺乳动物的心肌细胞则具有一定的再生能力,能够在出生后的短暂时段内完全恢复受损的心肌组织。这种从幼稚的增殖型心肌细胞到收缩型成熟心肌细胞的转变,主要依赖于其线粒体和代谢层面的转变:即线粒体的成熟,及由糖酵解为主的代谢途径转换至由线粒体氧化磷酸化的代谢途径。许多研究发现,通过抑制心肌细胞对脂肪酸的利用,或者促进心肌细胞代谢方式由线粒体氧化磷酸化向糖酵解转变,均能够有效促进内源性心肌细胞增殖。线粒体作为代谢的结构基础,其成熟的标志之一就是线粒体DNA转录和翻译的显著上调。基于此,研究者们认为,将线粒体代谢引导至相对不成熟的状态(如:线粒体蛋白翻译下调),可能使心肌细胞重获幼稚的增殖表型,但关于心肌细胞增殖过程中的线粒体如何发挥作用,及其具体的分子机制仍待进一步探索。
除此之外,研究者们还认为,即便在心脏发育成熟之后,线粒体稳态依然对心肌的收缩功能十分重要。有报道称,强力霉素处理会导致线粒体发生轻度未折叠蛋白反应,进而使细胞周期和分裂相关基因被激活;此外线粒体未折叠蛋白反应使真核翻译起始因子2亚基1 (eIF2α)被其激酶磷酸化。eIF2α的磷酸化导致ATF4和ATF5等转录因子的编码增加,并随后转运到细胞核中,激活相关下游基因的转录。MRPS5是线粒体核糖体的重要组成部分,对线粒体蛋白翻译极其重要。据此,研究团队通过构建心肌特异性Mrps5杂合型敲除小鼠来构建线粒体蛋白翻译减少的模型,发现其可通过激活ATF4信号来增强心肌细胞增殖和心脏再生。
研究内容 1. Mrps5 杂合小鼠心肌细胞增殖增加 研究人员首先在心脏中对Mrps5进行了特异性突变,结果发现小鼠心脏出现线粒体缺陷和显著的心力衰竭。令人意外的是,研究人员在构建的心脏特异性Mrps5杂合子小鼠(Mrps5cHET)中,发现心脏体积显著增大(图1a、1b),且Mrps5cHET小鼠的心脏质量/体重的比值在P4至P28中显著上调(图1c)。组织切片和小麦胚凝集素染色后定量显示,Mrps5cHET个体的心肌细胞大小在P14、P21和P28等时间点均显著性减小(图1d、1e)。为了更好的观察心肌细胞大小与成核之间相关关系,研究者分离了两组小鼠的成年心肌细胞,结果发现在Mrps5cHET心脏中单核心肌细胞增加,双核心肌细胞减少,多核心肌细胞则无明显差异(图1f)。除以上观察从结果侧面提示Mrps5cHET个体的心肌细胞增殖增加之外,研究人员还在出生后4d到2个月对Mrps5cHET心脏进行了一系列增殖标记物的免疫荧光染色分析。结果发现,增殖标记物Ki67、有丝分裂标志物pH3和有丝分裂激酶AuroraB阳性的心肌细胞在P4至P28的Mrps5cHET心脏中数量显著增加(图1g-j)。到生后2个月,心肌细胞增殖的增加趋势逐渐减弱(图1l)。为了确定成年后Mrps5的减少是否也能促进心肌细胞增殖,研究人员接下来构建了他莫昔芬(TAM)诱导的心脏特异性Mrps5杂合子小鼠(Mrps5iHET),并将其与谱系追踪系统(MADM)小鼠品系进行交配,以检测心肌细胞的分裂。通过对成年Mrps5iHET;MADM小鼠进行观察,结果发现心脏特异性Mrps5杂合子小鼠显示出更多单标记的绿色或红色心肌细胞,表明Mrps5减少诱导了新的心肌细胞形成。这些发现揭示,在不产生心功能受损或心脏疾病标记物上调的基础上,线粒体翻译的减少促进了出生后及年轻成年期的心肌细胞增殖。 图1.Mrps5杂合小鼠心肌细胞增殖能力增强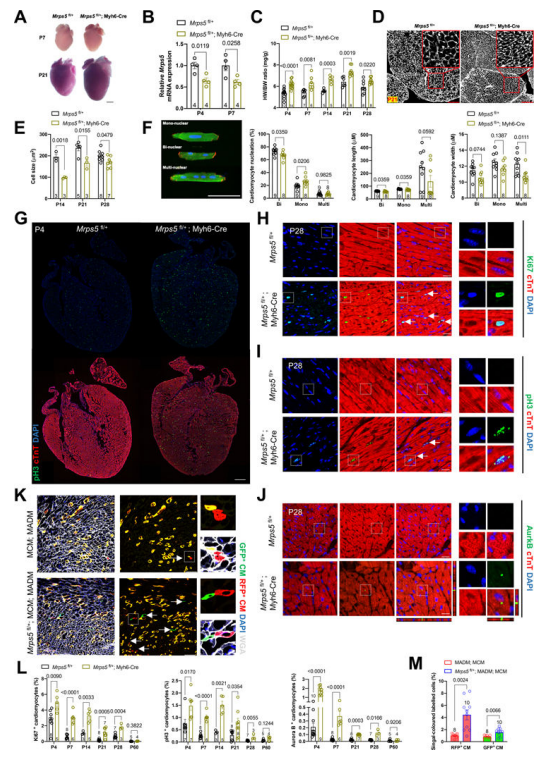
2. Mrps5 水平降低可增强成年小鼠的心脏再生 研究人员对TAM诱导型心脏特异性Mrps5杂合子小鼠(Mrps5iHET)进行TAM注射,并在之后一周通过左前降支结扎进行心肌梗死(MI)模型诱导。之后在如图所示的各个时间点分别进行心脏超声,细胞增殖,以及细胞死亡和细胞大小的检测(图2a)。对术后3周至7周的超声心动图的射血分数和短轴缩短率的分析,结果显示,MI后的Mrps5iHET小鼠的射血分数以及短轴缩短率均比对照组明显提高,梗死面积明显减小,这提示Mrps5iHET组小鼠保留了更好的心脏功能(图2b-e)。通过对MI后7天的心肌细胞进行增殖标志物检测,研究人员发现Mrps5iHET组小鼠pH3和AuroraB阳性心肌细胞的比例显著上调(图2f-g)。无独有偶,MI后3周和9周,Mrps5iHET组小鼠成年心肌细胞表现出EdU的混入增加,进一步支持了这一结果(图2h-i)。对心脏切片进行染色发现,Mrps5iHET组小鼠心脏中心肌细胞体积较小,这也从侧面反映该组小鼠MI后心肌细胞增殖增强(图2j)。通过末端脱氧核苷酸转移酶dUTP切口末端标记(TUNEL)染色检测心肌细胞死亡,发现MI后3周Mrps5iHET心脏中TUNEL阳性的心肌细胞显著减少(图2k)。研究人员还在Mrps5iHET;MADM心脏中发现了更多单标记的绿色或红色心肌细胞,表明Mrps5减少促进MI后心脏再生(图2l)。总之,这些数据表明成年小鼠中Mrps5降低导致线粒体翻译的减少,进一步激活心肌细胞增殖保护心脏免受MI相关的损伤。 图2.Mrps5降低导致成年心脏再生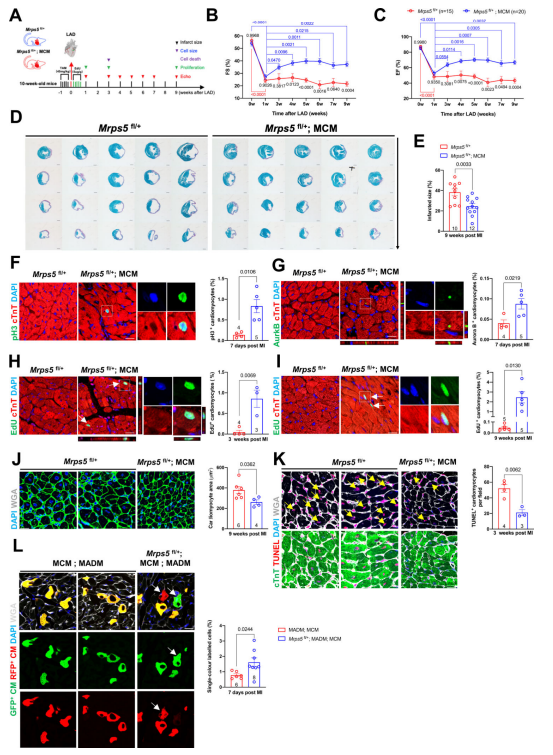
3. 减少线粒体翻译会触发线粒体应激反应并激活ATF4信号通路 以往研究提示,细胞和线粒体应激主要通过eIF2α、GCN2和PERK介导,其中eIF2α的磷酸化与细胞应激反应过程中整体翻译抑制状态有关。在本研究中,研究者在Mrps5cHET小鼠中关注到Mrps5下调导致的翻译减少使GCN2和PERK的蛋白水平显著增加,p-eIF2α有显著增加,但总eIF2α蛋白没有显著增加(图3a-c)。此后,通过对p-eIF2α的众多下游因子进行分析,研究团队发现Atf4在mRNA水平显著升高,且Mrps5下调介导的翻译受损仅仅特异性激活心脏中的 GCN2/PERK-eIF2α-ATF4 通路,而并不对其下游ATF5等其他分子进行活化(图3d)。在Mrps5iHET梗死心脏中,Atf4的上调等类似表型也被观察到;但在MI后7天,Mrps5iHET心脏中其他线粒体应激反应分子的水平也增加(图3e)。接下来,研究人员检测了线粒体翻译减少是否影响了Mrps5cHET心脏中线粒体的结构和功能。透射电镜检查未发现Mrps5cHET小鼠和对照小鼠心脏线粒体形态的差异(图3f)。此外,与对照组相比,Mrps5cHET小鼠的ROS和ATP含量均没有变化(图3g-i)。在TCA循环、线粒体电子传递链以及糖酵解相关基因的表达水平, Mrps5cHET与对照心脏之间同样没有显著差异(图3j)。在乳鼠心肌细胞中用siRNA敲低Mrps5后,耗氧速率略有降低,其余代谢指标则无显著变化(图3k)。这些数据表明,尽管在Mrps5杂合子小鼠中线粒体翻译减少,但正常的线粒体仍然得以维持,且与ATF4信号通路激活相关。 图3.线粒体翻译减少将触发线粒体应激反应并激活ATF4信号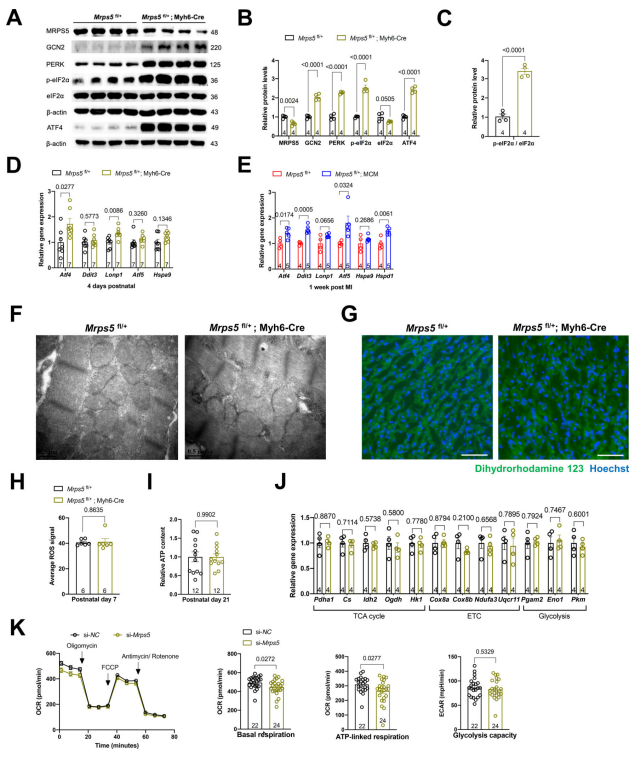
4.抑制ATF4可减少Mrps5杂合子心脏中的心肌细胞增殖并消除心脏再生潜力 ATF作为一个高度保守的转录因子,其被报道可激活哺乳动物和果蝇细胞的增殖。为了确定ATF4是否在成年Mrps5杂合子小鼠的心肌细胞增殖调控中发挥作用,研究人员利用TAM诱导系统构建了可诱导的Mrps5和Atf4双杂合子小鼠(idHET)及对照(idCtrl),并在以上各个时间点对各组小鼠进行以上的各方面检测(图4A)。在测量心脏大小以及心脏重量/体重比值时,研究人员发现Mrps5iHET小鼠心脏大小和HW/BW比值均表现出显著增加,但这种增加在idHET小鼠心脏中被抑制(图4B-C)。单个心肌细胞大小的观测同样发现心肌细胞大小在Mrps5iHET心脏中减小,而idHET小鼠的心肌细胞大小则相对Mrps5iHET显著增大并与idCtrl小鼠相似(图4D)。以上结果均从侧面提示了ATF4基因的抑制使得心肌细胞增殖受损。通过EdU混入实验检测心肌细胞增殖能力,研究人员发现注射TAM后2周和4周的Mrps5iHET组心肌细胞增殖增加,而idHET组心肌细胞增殖与idCtrl组无明显差异(图4E-F)。通过对pH3和AuroraB等细胞增殖相关的蛋白标记物进行免疫荧光染色,研究人员发现在Mrps5iHET心脏中进行有丝分裂和胞质分裂的心肌细胞数量增加,而在idHET心脏中则急剧减少。这进一步证实了ATF4基因的正常表达在Mrps5杂合子小鼠出生后和成年期心肌细胞增殖过程中发挥重要作用。 图4.抑制ATF4将损伤Mrps5iHET小鼠心肌细胞的增殖能力增强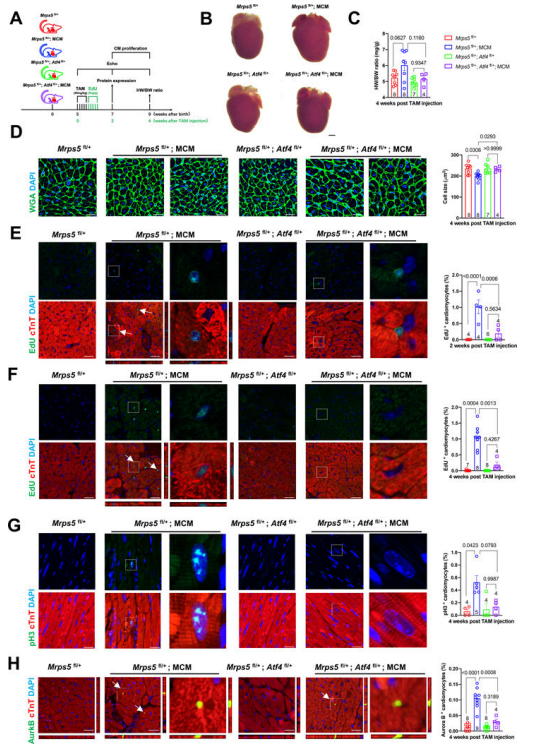
为了证实在Mrps5杂合子小鼠中观察到的心脏再生能力的显著增强是通过激活ATF4信号介导的,研究人员在成年iCtrl,Mrps5iHET,idCtrl和idHET小鼠中进行了MI(图5A)。MI后一周,四组小鼠的心功能并未表现出显著差异,而在连续时间点的心脏超声结果中,仅仅观察到Mrps5iHET小鼠在MI处理后3周和5周有心功能的显著改善,但在其他3组小鼠中没有观察到(图5B-C)。在MI处理5周后的梗死面积评估中,研究者发现idHET心脏并未表现出可以使得梗死面积减小的能力(图5D)。通过对一系列相关基因的qPCR验证,研究人员发现Mrps5的表达水平在iHET和idHET组中降低,而Atf4的表达仅在iHET组中增强。一系列细胞增殖标志基因(如,Mki67、Aurkb和Top2a)的表达趋势则与ATF4相同,也仅在iHET心脏中表达上调(图5E)。通过对MI处理后不同时期的心肌的EdU混入情况进行观察,研究人员发现在Mrps5iHET心脏中,EdU阳性的心肌细胞比例显著增加,而在idHET心脏中,EdU阳性的心肌细胞比例显著减少(图5F-G)。 图5.抑制ATF4可降低Mrps5iHET小鼠心脏的梗死后再生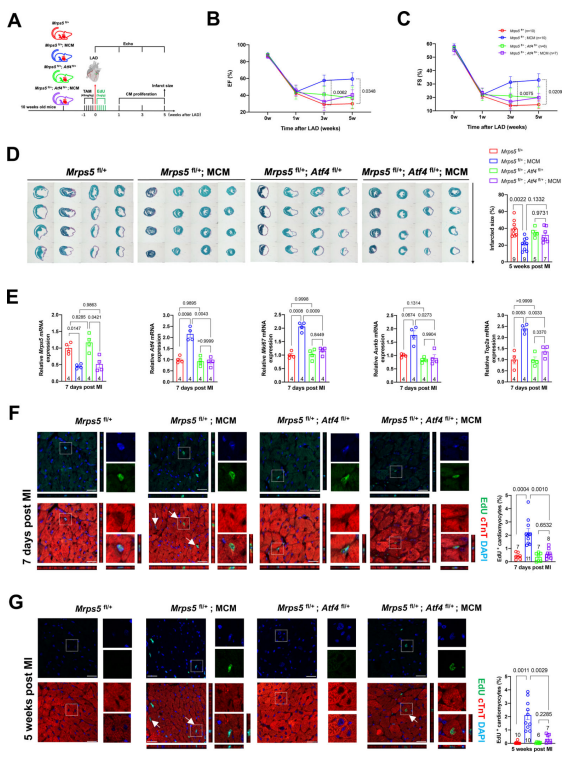
5. ATF4调节Mrps5cHET心脏中细胞分裂相关基因的表达并促进心肌细胞增殖 为了深入了解线粒体翻译减少引发心肌细胞增殖的潜在分子机制,研究人员对P4的Mrps5cHET心脏进行了RNA-seq,并与对照组心脏进行比(图6A)。通过对Mrps5cHET心脏中877个上调基因进行分析,研究者发现GO富集分析和GSEA集富集分析均显示上调的通路大多与细胞增殖和分裂(例如,细胞分裂,染色质分离,核DNA复制和有丝分裂胞质分裂途径)有关(图6B-C)。进一步,研究人员通过qPCR验证了P4和P28时Mrps5cHET心脏中细胞分裂相关基因的上调(图6D)。研究人员鉴定了超过4880个假定的ATF4结合峰,这些基因包括Knl1、Mki67、Top2a、Kif11和Incenp等已知对细胞分裂和增殖有重要作用的基因(图6E)。通过ChIP-qPCR,研究人员证实了ATF4与Knl1启动子的强结合,通过荧光素酶报告分析进一步验证了这种相互作用,其中强制过表达ATF4增加了Knl1启动子的活性(图6F-G)。研究人员还发现Mrps5cHET小鼠心脏中KNL1蛋白水平升高,与ATF4蛋白水平升高相关(图6H)。此外,研究人员发现在Mrps5cHET心脏中显著上调的84个基因中,有21个与ATF4结合,这提示这些基因的转录上调很有可能收到ATF4与其启动子结合的影响(图6I)。 对以上21个基因进行GO分析发现,它们与细胞分裂、核分裂、染色体分离和染色质组织有关(图6J)。而关于其余63个基因进行GO分析,发现核染色体分离基因在Mrps5cHET心脏中富集最显著。这些数据支持ATF4在Mrps5cHET心脏细胞分裂相关基因的转录调控中发挥作用(图6K)。 图6.ATF4在Mrps5cHET小鼠心脏中调控细胞分裂相关基因表达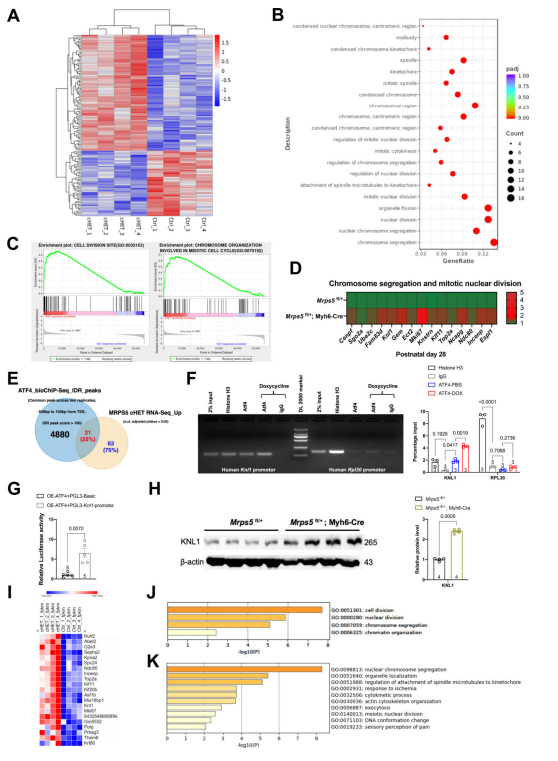
6. 强力霉素诱导轻度线粒体应激并促进心脏再生 为了确定Mrps5-ATF4这一信号通路是否参与了之前讨论的强力霉素研究中观察到的心脏保护和心脏再生,研究人员用强力霉素处理成年野生型小鼠,并进行MI手术诱导,并在后续时间点观察心功能和心肌细胞增殖情况(图7A)。超声心动图显示,在MI后5周,强力霉素治疗的小鼠表现出更好的心脏功能(图7B-C)。此外,在MI后5周,研究人员还观察到强力霉素处理过的小鼠心脏的梗死面积显著减小(图7D)。通过免疫荧光染色检测心肌细胞内混入的EdU,pH3以及AuroraB等细胞增殖相关指标,研究人员发现与对照组相比,多西环素注射小鼠的心肌细胞中,DNA复制、有丝分裂和胞质分裂的水平均显著增加(图7E-G)通过Western Blot,研究人员发现多西环素处理激活了线粒体应激反应,表现为MI后1周p- eIF2α及其上游激酶GCN2和PERK的增加;此外还发现在多西环素处理的心脏中,ATF4和Knl1的蛋白水平在MI后均增加(图7H)。综上所述,强力霉素抑制线粒体翻译通过激活eIF2α-ATF4-Knl1信号通路促进心肌细胞增殖和心脏再生。 图7.强力霉素导致轻柔的线粒体应激并促进心脏再生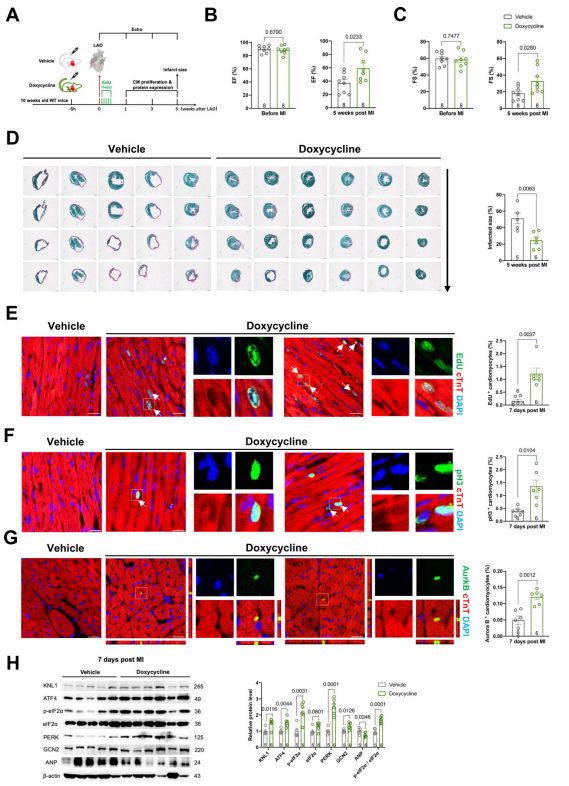
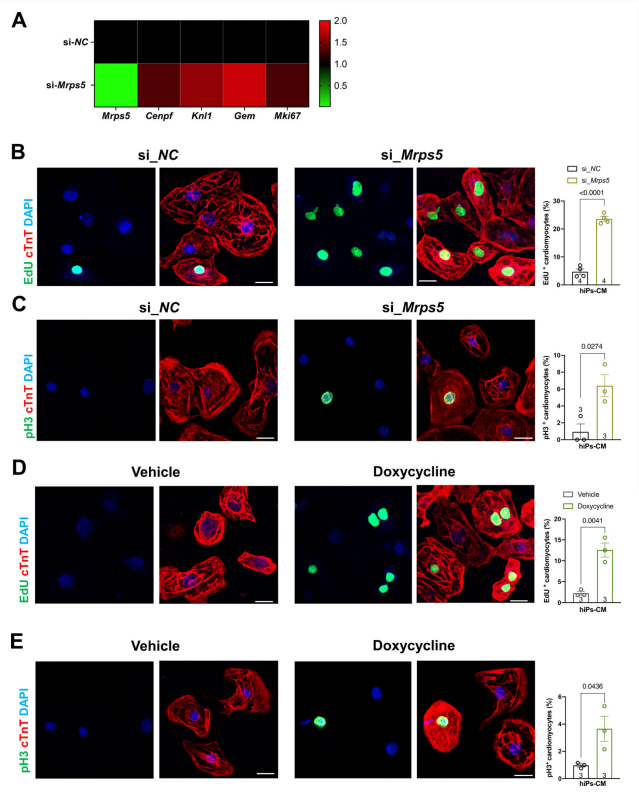
7. 抑制线粒体翻译可增强hiPSC-CM 中的心肌细胞增殖 为了探究以上机制在人类心肌细胞中是否同样有效,研究人员敲低了人类诱导多能干细胞衍生的心肌细胞(hiPSC-CM)中的Mrps5。发现当Mrps5被抑制时,细胞分裂相关基因,包括Cenpf,Knl1,Gem和Mki67的表达增加,这与研究人员在小鼠心脏中观察到的结果一致(图8A)。通过转染Mrps5基因的小干扰RNA,研究人员还发现,Si-Mrps5样本中EdU掺入和pH3染色增加,这提示抑制Mrps5导致hiPSC-CMs中细胞增殖显著增加(图8B-C)。与之前的实验一致,多西环素处理也促进了hiPSC-CMs中心肌细胞的增殖。这些数据表明,线粒体翻译的减少可以显著促进hiPSC-CMs中的细胞增殖(图8D-E)。 图8.在hiPSC-CM中抑制线粒体翻译将增强心脏再生 总结与展望 这项研究的意义在于提出了通过调节线粒体翻译来促进心脏再生的新策略,尤其是在心肌梗死(MI)后的恢复中其可能具有的临床应用价值。ATF4信号通路在心肌细胞增殖和心脏再生中扮演了关键角色,并通过调控一系列与细胞增殖相关的基因,促进心脏的修复与再生,为后续研究提供了一个新的机制视角。由于心肌细胞的能量来源主要来自脂肪酸的有氧氧化,这对线粒体的功能提出了较高的需求,因此,mtDNA的基因表达对成年人的心脏健康也十分重要。未来需要研究者进一步探讨,如何在不引起心肌细胞脂质代谢异常等不良因素的情况下优化线粒体翻译减少的程度,以确保其对心脏再生的促进作用最大化。 原文链接: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.061192 小编:李明皓