Science丨Nr5a2对合子基因组激活是非必要的但对于桑葚胚的发育是必不可少的
研究背景
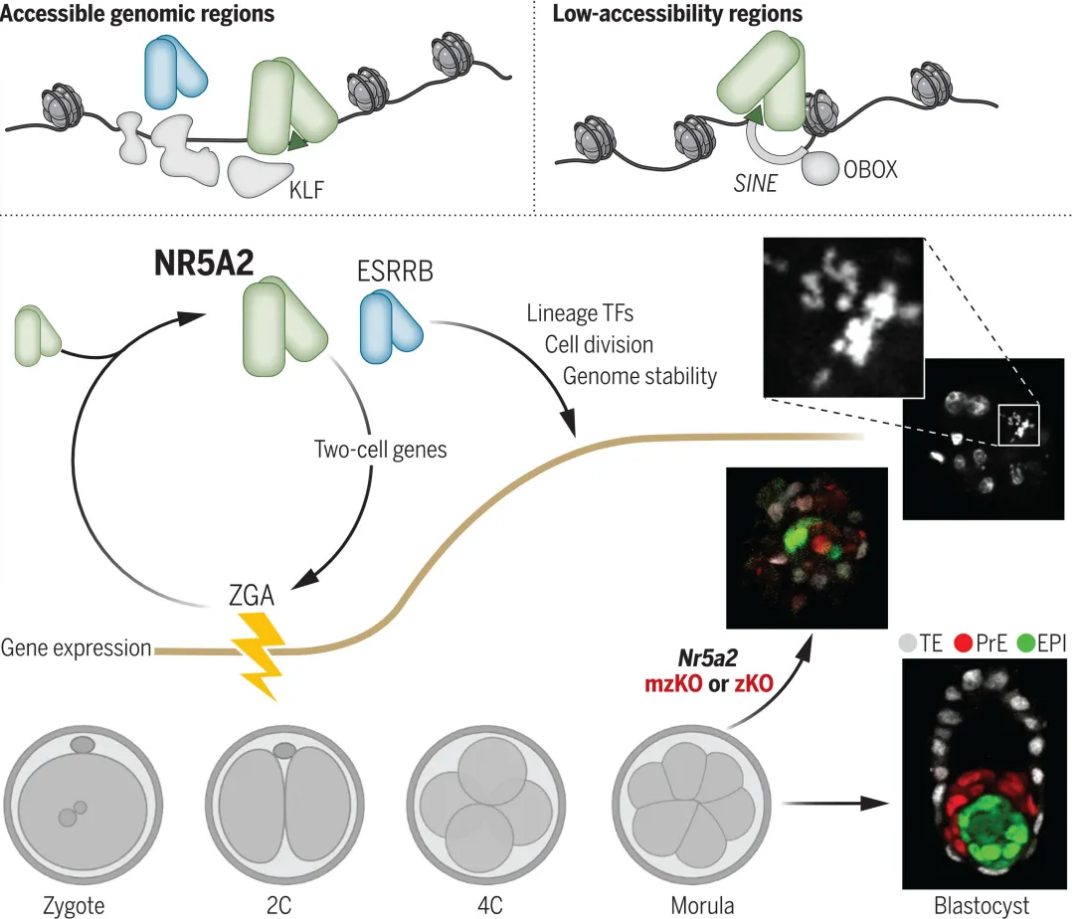
NR5A2控制着床前胚胎发育
早期胚胎发生由转录因子驱动,转录因子首先激活合子基因组,进而调控囊胚谱系。谱系决定始于8细胞桑葚胚,并依赖于合子基因组激活(zygotic genome activation, ZGA)。虽然指定各个谱系的转录因子(transcription factors, TFs)网络已被表征,但卵裂球是如何通过ZGA进展并启动这些早期基因调控程序目前尚不清楚。2024年10月4日,法国巴斯德研究所表观基因组学单元的研究人员在Science杂志上发表了题为Nr5a2 is dispensable for zygotic genome activationbut essential for morula development的文章,发现孤儿蛋白受体NR5A2在合子激活到桑葚胚这个发育阶段发挥关键作用。
在哺乳动物中,着床前胚胎发育涵盖了从受精卵到复杂结构(囊胚)的转变,囊胚由3个谱系构成,并产生所有胚外组织和胚胎组织。胚泡谱系的确定始于桑葚胚,桑葚胚由16-32个细胞组成,由合子的连续分裂和压实产生,通过几种转录因子(transcription factors, TFs)分级作用介导完成,包括:TEAD4,GATA3和CDX2负责胚胎外滋养外胚层(extraembryonic trophectoderm, TE)分化;SOX2和OCT4等支持内细胞团(inner cell mass, ICM)的形成,促成早期胚胎形成;NANOG和GATA6促进胚胎多能外胚层(embryonic pluripotent epiblast, EPI)形成,并由胚胎外原始内胚层(extraembryonic primitive endoderm, PrE)形成具有着床和进一步发育能力的晚期囊胚[1]。调控囊胚形成的大量转录因子功能已基本明确,但何种转录因子保证了正常桑葚胚形成目前仍不清楚。
转录因子还与小鼠发育开始的第一个调控步骤——合子基因组激活(zygotic genome activation, ZGA)有关,ZGA在两细胞(2 Cell, 2C)阶段启动转录[2]。与谱系决定不同,许多在囊胚形成中起着重要作用的转录因子,诸如DUX, RARG, DPPA2/4, NFYA等,在ZGA阶段虽被干扰,通常不会损害ZGA或两细胞阶段的进展[3,4]。最近有两类转录因子被提出在ZGA过程中发挥优势作用:OBOX和孤儿核受体NR5A2[5,6]。但NR5A2的作用仍存在争议。在NR5A2的化学抑制下,培养胚胎的发育早在2C阶段就发生了阻滞,这种表型在很大程度上与受损的ZGA有关[6]。而使用碱基编辑技术的研究则表明,NR5A2在后期发挥主要作用,控制谱系决定因子的转录[7,8]。这些相互矛盾的研究指出NR5A2作为早期胚胎发生调节剂的重要性,但目前尚缺乏来源Nr5a2稳定敲除模型的结论。因此,在NR5A2缺乏的情况下,胚胎是否可以在宫内正常发育,且观察到的相关发育表型是否由NR5A2作为ZGA的启动者介导的,还是在其合子表达后期通过基因调控介导的,这些问题仍存在不确定性。考虑到雌激素相关受体b(estrogen-related receptor b, ESRRB)等在维持小鼠胚胎干细胞(embryonic stem cells, ESCs)多能性基因调控网络活性方面的冗余,这使得明确NR5A2的关键功能变得更加复杂[9,10]。因此,在本文中,研究人员建立了稳定可诱导的KO小鼠模型,以确定胚胎植入前NR5A2的作用,并研究其与ESRRB的潜在功能互作。
研究内容
1.母源表达的NR5A2和ESRRB在胚胎发生中是非必要的
为研究NR5A2和ESRRB在着床前发育中的作用,研究人员繁育了Esrrb和/或Nr5a2条件敲除的雌性小鼠,并结合Zp3:cre。这一研究策略可用于Nr5a2(NrKO)和Esrrb(EKO)及两者(oKO/DKO)母源缺乏(maternal, mKO),合子缺乏(zygotic, zKO),或母源-合子缺乏(maternal and zygotic, mzKO)的胚胎表型研究。研究人员首先对母源Nr5a2和Esrrb缺失的影响进行了研究。结果发现,卵母细胞缺乏NR5A2, ESRRB或两者的雌性产下的幼崽与匹配对照的幼崽大小无显著差异(图1A),有效地传递了缺失的等位基因。排除了NR5A2或ESRRB在母源遗传中的决定性作用。通过观察oKO卵母细胞或mzKO胚胎,在ZGA之前(GV oocyte)或前后(2C)研究者没有发现NR5A2的表达(图1B),而在之后的4细胞(4 Cell, 4C),8/16细胞阶段(8/16C)的桑葚胚时期,NR5A2的表达可以被观察到。同样,对Esrrb-TdTomato报告小鼠的卵母细胞和胚胎进行观察,发现ESRRB很大程度上不是母源遗传的,仅在2C晚期阶段才可被检测到(图1C)。以上结果表明,NR5A2和ESRRB并不是关键的ZGA母源调控因子。

图1. 着床前发育不需要母源NR5A2和ESRRB
2.NR5A2在ZGA期间发挥非必要作用
Nr5a2 mKO在2C阶段的正常发育与最近NR5A2作为关键的ZGA调控因子的提议产生了矛盾[6]。为了进一步评估NR5A2在ZGA过程中的潜在作用,研究人员对102个对照和Nr5a2 oKO的卵母细胞以及mKO,zKO及mzKO的早期2C(E2C)进行了全长单细胞RNA测序(FLASH-seq)。同时,还在ZGA之后晚期2C(L2C)、早期4C和8C阶段分析了122个对照,NrKO,EKO或oKO的mzKO胚胎。结果显示,Nr5a2缺失的生长中卵母细胞在受精前的基因表达差异极小(图2A和2B),说明KO胚胎和对照胚胎的发育起点几乎相同。少量基因在ZGA前后受到影响:即在mzNrKO胚胎中,差异表达基因(differentially expressed genes, DEGs)在E2C阶段也很少。相似地,在L2C阶段,mzDKO和mzNrKO胚胎也表现出有限的基因表达差异(图2A和2B)。随后,基因表达差异逐渐增大,特别是在8C阶段,有超过2000个基因表达受到mzNrKO的影响(图2A和2B)。此外,从L2C阶段开始,当一组不同的基因开始在mzNrKO或mzDKO中差异表达时,原本E2C胚胎依赖于NR5A2的基因表达在KO组中不受影响(图2B和2C)。这表明NR5A2和ESRRB的两种非重叠功能之间的急剧转变,可能取决于ZGA前后胚胎的不同转录景观。
随后研究人员评估了ZGA过程中,NR5A2缺失对被激活的2107个基因表达的影响[6],结果并没有观察到它们在卵母细胞到8C胚胎表达谱的全局变化,说明在所有突变体中ZGA程序基本正确,NR5A2和ESRRB在这一阶段并未发挥关键作用(图2D)。在E2C胚胎中,母源Nr5a2的完全缺失(mNrKO)仅破坏了11个基因的激活(图2E左)。在进一步合子Nr5a2缺失(mzNrKO)之后也仅有5%的ZGA基因表达异常(图2E中)。在L2C阶段,当ZGA基本完成时,Nr5a2和Esrrb的mzDKO仅影响71个基因的表达(图2E右)。类似改变在Nr5a2 mzKO和zKO中被发现,提示合子表达的NR5A2是这些基因改变的主要因素。此外,在2C胚胎中,应答基因在NR5A2结合区域附近表现出弱富集(图2F),提示间接调控的可能性。以上结果说明,母源与合子Nr5a2表达有助于调控一小部分ZGA基因。
除单拷贝基因外,ZGA还具有几个重复元件的转录特征(MERVLs, MaLRs , SINE B1/Alu 等元件),以促进附近基因的表达(SINEs, short interspersed nuclear elements)。研究者发现,尽管NR5A2和SINE有部分结合,但与其他两者的关系不甚显著,在L2C胚胎中仅有MERVL有轻微下调趋势(图2G),进一步证实Nr5a2的功能在ZGA阶段是可有可无的。此外,仅有少数E2C阶段的特定调控因子基因,如Zscan4和Tscstv出现在该阶段的DEGs中。
随后,研究人员分析了高度表达于E2C阶段的358个基因,分别有10个和66个基因在Nr5a2 mKO和mzKO中下调(图2H)。尽管如此,这些基因并没有富集于NR5A2作用的区域附近(图2I)。这表明NR5A2介导一小部分的E2C特异性基因的激活。研究人员又检查了已知的ZGA调控因子,Obox和Dux是否受到NR5A2的影响,但是这些基因的表达没有增加,排除了它们可能在功能上代偿性弥补NR5A2缺失。此外,研究团队也并未发现受Nr5a2和Esrrb mzKO影响的基因与Dux mzKO在2C时期之间存在交集。然而,根据OBOX对Nr5a2的激活效应,在Obox mzKO中存在到部分交集基因,提示NR5A2可能在于这些基因的下游发挥作用。
综上,合子和母源表达的NR5A2在合子转录开始后参与基因表达调控,然而,NR5A2并不是ZGA的必要调控因子。NR5A2仅支持一小部分ZGA和E2C特异性基因的激活,这些作用是短暂的,可能是间接的,并依赖于其合子和母源的联合表达。L2C阶段,ZGA在所有突变体胚胎中都已基本完成,NR5A2表达增加,开始与ESRRB调控一组独特的基因。

图2. 在NR5A2完全缺失的情况下,ZGA继续进行仅轻微缺陷
3.合子表达的NR5A2对桑葚胚的发育至关重要
鉴于在8C阶段出现了广泛的转录失调(前述超过2000个以上DEGs),研究团队试图评估Nr5a2和Esrrb母源及合子缺失对ZGA之后胚胎发育的影响。已知Esrrb的遗传缺失仅在着床后才会引起胚外谱系的发育缺陷[11]。与此一致的是,Esrrb mzKO不影响着床前发育:在胚胎发育的第4.25天(E4.25),可以从形态正常的突变囊胚中分离出已经完成谱系分化的细胞(图3A和3C)。但所有E3.5-E4.25 Nr5a2 mzKO的胚胎则表现出严重的形态异常和显著的发育迟缓(图3B和3C),伴随细胞数量减少,细胞核形态退化,以及细胞分裂的无序进展(图3D)。为排除遗传背景造成的潜在偏差(C57BL/6),研究团队又在CD-1和C57BL/6混合背景进行了验证,得到了同样结果。因此推断,合子中Nr5a2的表达可能发挥了主导作用。为了确认NR5A2在4C期后的功能,及排除任何早期作用的影响,研究团队采取了两种互补策略:i)在mzKO出现形态学缺陷之前诱导Nr5a2的缺失;ii)从4C期挽救NR5A2缺陷。对于第一种方法,研究人员使用了他莫昔芬诱导的ROSACre-ERt2驱动。结果显示,在ZGA完成后,mzKO突变体中观察到的表型异常是通过触发Nr5a2的丢失来重现的。相反,在ZGA之后的4C期,注射体外转录的Nr5a2 mRNA可挽救mzNr5a2KO胚胎的幼鼠致死率和发育迟缓(图3E)。以上结果排除了母源Nr5a2表达对于ZGA期间的重要作用,进一步确定突变体胚胎的发育失败是由于合子NR5A2的丢失。
为了确定突变体中首要缺陷出现的时间,研究团队培养了在4C期分离的Nr5a2 mzKO胚胎。实时成像显示发育迟缓和缺陷在8C期后逐渐发生,到对照胚胎形成胚泡时,突变体的桑葚胚完全退化。在宫内E2.75(8C-16C),Nr5a2 mzKO和DKO的mzKO胚胎中,NANOG和GATA3在部分胚胎细胞中的表达受到抑制,但是大多数细胞继续表达GATA6(图3F)。在E2.5时,突变体已表现出发育迟缓(图3C),以及早期NANOG表达消失。上述结果提示合子NR5A2在第一谱系分离和桑葚胚形成过程中的关键性作用。
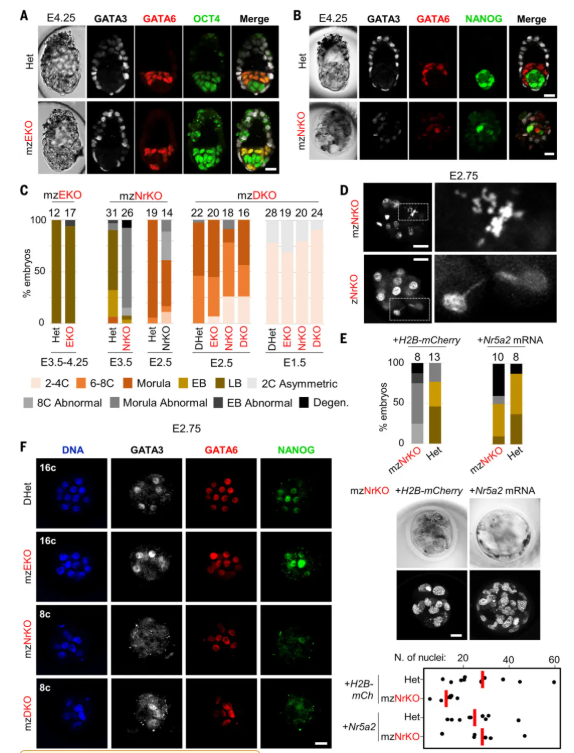
图3. NR5A2是正常桑葚胚发育所必需的
4.NR5A2在调控谱系决定-细胞分裂-基因组稳定性方面占主导地位
鉴于在8C阶段观察到的严重表型,研究团队进一步探讨了母源和合子Nr5a2和Esrrb缺失对ZGA之后胚胎发育的影响。如前所述,与突变胚胎明显缺陷的一致,基因失调从L2C到8C逐步增加。2C和4C阶段的基因表达趋势基本一致,突变胚胎中缺失表达的DEG之间的重叠更强。在4C阶段受影响的基因在8C阶段也表现出一致性的变化,但基因调控的整体相似性不太明显。Esrrb mzKO对8C期有轻微的影响,而Nr5a2 mzKO再现了双重Esrrb和Nr5a2 mzKO的效果(图4A,4B和4C)。通过对这些影响的可视化分析,发现Nr5a2 mzKO和mzDKO胚胎仅在4C阶段开始与野生型和Esrrb mzKO胚胎分离,并在8C阶段与对照几乎完全分离(图4D)。
为表征NR5A2在L2C到8C阶段所调控的基因,研究团队在实验条件下结合所有DEGs进行了基因本体(GO)分析(图4E)。发现如“囊胚”和“胎盘发育”等发育术语是最为富集的,包含了EPI(Nanog, Klf4, Sox15)和TE(Tead4, Tfap2c, Gata3, Klf5, Cdx2)谱系决定的关键效应基因。这些基因主要在Nr5a2 mzKO和mzDKO胚胎中8C期下调(图4F)。因此,提示NR5A2参与控制囊胚形成关键转录因子的表达调控。另一组关键GO术语与有丝分裂和细胞分裂缺陷有关(图4E),包括对着丝粒有丝分裂调控重要的基因(Cenpa, Haspin, Borealin, Shugosin)或细胞周期调节因子,这组基因主要在2C或4C阶段下调(图4F)。最后是一组关键GO术语与DNA修复,同源重组和端粒维持相关的基因相关(图4E),其中包括端粒蛋白和参与DNA复制和修复的基因,它们在端粒的维持中起着核心作用。

图4. 转录组在Nr5a2 KO胚胎中逐渐失调
5.NR5A2保证其调控基因集的染色质可及性
接下来,研究团队进一步探究了NR5A2与这些差异基因之间的转录调控关系。利用NR5A2缺失模型,他们通过转座酶可及染色质测序测定(assay for transposase-accessible chromatin sequencing, ATAC-seq)测量了染色质可及性的变化。研究团队不仅分析了E2C阶段(合子NR5A2首次表达时期)诱导NR5A2功能丧失的胚胎,还对8C胚胎中由NR5A2结合的16958个基因组区域进行了分析,结果发现NR5A2以相似的比例结合在可及区和低或不可及区(图5A)。尽管作用于低可及性区域符合先锋转录因子的活性,但NR5A2的这种结合并不一定是可及性变化的直接原因。为了确定这两类结合位点之间的潜在差异,他们分析了这些位点的DNA序列。结果发现,NR5A2基序在绝大多数结合区域富集,表明招募是直接与DNA结合驱动的。被OBOX因子靶向的同源盒基序也存在于NR5A2占据的区域。与此一致的是,与NR5A2和OBOX结合相关的重复元件在NR5A2结合区域显示出有限的差异富集。SINE元件在非可及性染色质中富集,而ERVLs则集中于可及区(图5A)。其他早期胚胎发生中起关键作用的转录因子,KLF和TFAP2c,集中于NR5A2位点附近最易接近的区域(图5A)。以上表明NR5A2可以单独结合DNA发挥作用,也可以与特定类型的发育因子互作,调控染色质可及性。Nr5a2 mzKO可导致近一半ATAC信号靶点的减少,但仅有8%的靶点显示可及性增加。除此之外,mzKO中ATAC信号升高的位点变化不大,提示NR5A2间接影响其他区域的可能性。因此,NR5A2可能主要通过增加其靶点处的染色体可及性。
6.NR5A2通过不同机制调控基因
最后,研究团队试图将染色质可及性的变化与基因调控联系起来。通过分析发现,由NR5A2激活的基因近端区域(上下游50 kb)在KO胚胎中更易丢失染色质可及性(图5B)。同样NR5A2调控基因在NR5A2结合区和可及性附近富集。在KO胚胎中,由NR5A2激活的基因表现出附近区可及性的显著丢失(图5C),而NR5A2抑制的基因则表现出相反的模式。其中与ICM或TE相关的基因、及参与有丝分裂的管家基因等,NR5A2的这种直接调控迹象在整体范围内都是显著的(图5D)。与那些非NR5A2调控区域等区域相比,上述与ICM或TE相关的及参与有丝分裂的基因类目中接近NR5A2阳性靶向区域者在Nr5a2 KO后显示出更为显著的染色体可及性降低(图5D)。然而,研究显示NR5A2未必需要在结合位点建立可及性来调控基因表达,因为其结合但不可及的区域在也存在调节基因的富集(补图5D)。因此,NR5A2似乎可以直接激活对胚胎发育和谱系决定关键基因的表达,如Tead4(图5E,以Tead4的激活模式为例)。他们还观察到,在8C阶段,NR5A2调控的基因产生起源于ERVL元件的嵌合转录物(图5F)。这些与阳性靶标相连的ERVL元件通常紧邻NR5A2结合的SINE重复序列。结合他们之前的分析,这表明与SINE元件的结合使NR5A2的基因调控远远超过2C阶段,并揭示SINE和ERVL重复序列在基因表达调控中真实的合作关系。综上,他们的研究确定NR5A2是一个重要的发育调控因子,在连接ZGA到谱系决定的初始阶段直接调控基因表达。

图5. NR5A2促进了附近调控区域的染色质可及性
总结与展望
该项研究使用Nr5a2缺失的小鼠模型,发现Nr5a2-/-胚胎在桑葚胚早期阶段停滞,表现出谱系分化的受损、频繁的有丝分裂失败和大量染色体分离缺陷。尽管NR5A2在合子基因组激活过程中可能发挥一定的作用,但本项研究首次证实它在8细胞阶段发挥主要调控作用,控制谱系特异性转录因子表达,参与有丝分裂、端粒维持和DNA修复基因的表达,并通过调节染色质可及性发挥关键作用。该研究阐释了Nr5a2通过协调增殖、基因组稳定性和谱系特异性等途径,在桑葚胚发育过程中发挥重要作用。在早期胚胎发育的研究中,一些关键基因在调控时相上的差异,NR5A2分别在ZGA时期和8C期的作用强弱形成了强烈的反差。值得关注的是,本研究中NR5A2的功能妥善衔接了从ZGA结束到谱系决定阶段关键基因的表达调控机制,填补了这一阶段的研究不足,并对早期胚胎发育这一重大科学问题提供了新见解。
原文链接:
小编:莫佳航
参考文献:
[1] J. Rossant, Genetic Control of Early Cell Lineages in the Mammalian Embryo. Annu. Rev. Genet. 52, 185–201 (2018).
[2] K. N. Schulz, M. M. Harrison, Mechanisms regulating zygotic genome activation. Nat. Rev. Genet. 20, 221–234 (2019).
[3] C. Yu et al., Oocyte-expressed yes-associated protein is a key activator of the early zygotic genome in mouse. Cell Res. 26, 275–287 (2016).
[4] F. Lu et al., Establishing Chromatin Regulatory Landscape during Mouse Preimplantation Development. Cell 165, 1375–1388 (2016).
[5] S. Ji et al., OBOX regulates mouse zygotic genome activation and early development. Nature 620, 1047–1053 (2023).
[6] J. Gassler et al., Zygotic genome activation by the totipotency pioneer factor Nr5a2. Science 378, 1305–1315 (2022).
[7] L. Li et al., Lineage regulators TFAP2C and NR5A2 function as bipotency activators in totipotent embryos. Nat. Struct. Mol. Biol. 31, 950–963 (2024).
[8] Y. Zhao et al., Nr5a2 ensures inner cell mass formation in mouse blastocyst. Cell Rep. 43, 113840 (2024).
[9] N. Festuccia, N. Owens, A. Chervova, A. Dubois, P. Navarro, The combined action of Esrrb and Nr5a2 is essential for murine naïve pluripotency. Development 148, dev199604 (2021).
[10] A. Chervova et al., Mitotic bookmarking redundancy by nuclear receptors in pluripotent cells. Nat. Struct. Mol. Biol. 31, 513–522 (2024).
[11] J. Luo et al., Placental abnormalities in mouse embryos lacking the orphan nuclear receptor ERR-beta. Nature 388, 778–782 (1997).
[12] W. Kobayashi et al., Nucleosome-bound NR5A2 structure reveals pioneer factor mechanism by DNA minor groove anchor competition. Nat. Struct. Mol. Biol. 31, 757–766 (2024).




